ÍNDICE
|
12. Relación entre energía y velocidad de reacción
13. Propiedades de las reacciones químicas
14. Teoría cinético-molecular
1. magnitudes de un gas 17. Ecuaciones de los gases ideales o perfectos 1. Ley de Boyle-Mariotte 2. Ley de Charles y Gay-Lussac 3. Ley de Avogadro 4. Ley de Dalton de las presiones parciales
16. Cuestiones
17. Problemas
18. Prácticas
19. Otros contenidos
20. Vídeos
|
1. ESQUEMAS
2. PRESENTACIONES







Estequiometría y disoluciones
3. CONTENIDOS ANIMADOS
4. MATERIA Y SUS ESTADOS DE AGREGACIÓN
Materia es todo lo que tiene masa, ocupa espacio y se puede percibir por nuestros sentidos.
La materia puede existir en tres estados físicos y pasar de un estado físico a otro sin que cambie su composición
4.1. Sólido:
Los sólidos se caracterizan por tener forma y volumen constantes. Esto se debe a que las partículas que los forman están unidas por unas fuerzas de atracción grandes de modo que ocupan posiciones casi fijas.
En el estado sólido las partículas solamente pueden moverse vibrando u oscilando alrededor de posiciones fijas, pero no pueden moverse trasladándose libremente a lo largo del sólido.
Las partículas en el estado sólido propiamente dicho, se disponen de forma ordenada, con una regularidad espacial geométrica, que da lugar a diversas estructuras cristalinas.
Algunos ejemplos del estado solido son una piedra, un martillo de hierro, bola de acero...
4.2. Líquido:
Los líquidos, al igual que los sólidos, tienen volumen constante. Los líquidos se caracterizan por una resistencia al flujo llamada viscosidad.
La viscosidad de un líquido crece al aumentar el número de moles y disminuye al crecer la temperatura. La viscosidad también está relacionada con la complejidad de las moléculas que constituyen el líquido: es baja en los gases inertes licuados y alta en los aceites pesados. Es una propiedad característica de todo fluido (líquidos o gases).
En los líquidos las partículas están unidas por unas fuerzas de atracción menores que en los sólidos, por esta razón las partículas de un líquido pueden trasladarse con libertad. El número de partículas por unidad de volumen es muy alto, por ello son muy frecuentes las colisiones y fricciones entre ellas.
Así se explica que los líquidos no tengan forma fija y adopten la forma del recipiente que los contiene. También se explican propiedades como la fluidez o la viscosidad.
En los líquidos el movimiento es desordenado, pero existen asociaciones de varias partículas que, como si fueran una, se mueven al unísono. Al aumentar la temperatura aumenta la movilidad de las partículas (su energía).
Algunos ejemplos del estado liquido son agua, refresco, la sangre, el jugo, la leche, el mercurio...
4.3. Gas:
Los gases, igual que los líquidos, no tienen forma fija pero, a diferencia de éstos, su volumen tampoco es fijo. También son fluidos, como los líquidos.
En los gases, las fuerzas que mantienen unidas las partículas son muy pequeñas. En un gas el número de partículas por unidad de volumen es también muy pequeño.
Las caracteristicas del estado gaseoso es aquel estado de la materia en el cual las sustancias presentan volumen y forma indefinidos y muestran poca respuesta a la gravedad
Al aumentar la temperatura las partículas se mueven más deprisa y chocan con más energía contra las paredes del recipiente, por lo que aumenta la presión
Algunos ejemplos de este estado son, el agua al evaporarse, hidrogeno, dióxido de carbono…
SÓLIDOS
|
LÍQUIDOS
|
GASES
| |
| COMPRESIBILIDAD | No se pueden comprimir | No se pueden comprimir | Sí pueden comprimirse |
| VOLUMEN | Constante | Constante | Variable |
| FORMA | Constante | Variable | Variable |
GRADOS DE LIBERTAD
| Vibración | Vibración, rotación y traslación restringidas | Vibración, rotación, traslación |
| EXPANSIBILIDAD | No se expanden | No se expanden | Sí se expanden |
| Fuerzas entre partículas | Muy fuertes | Fuertes | Muy débiles |
| Disposición de las partículas | Ordenadas en posiciones fijas y cercanas | Bastante desordenadas y cercanas | Totalmente desordenadas y alejadas unas de otras |
4.4. Los cambios de estado
- Fusión es el paso de sólido a líquido.
- Solidificación es el paso inverso. Se producen a una temperatura concreta llamada temperatura de fusión.
- Evaporación es el paso de líquido a gas a cualquier temperatura.
- Condensación es el paso inverso también a cualquier temperatura.
- Ebullición es el paso de líquido a gas a la temperatura de ebullición.
- Licuación es el paso inverso también a esta temperatura determinada.
- Sublimación es el paso directo de sólido a gas sin pasar por líquido. Sublimación inversa o regresiva es el paso directo de gas a sólido. Ambos solo se dan en algunas sustancias, por ejemplo, el yodo o el alcanfor.
En algunos de estos procesos se consume calor y en otros se libera:
Fusión, evaporación, ebullición y sublimación son procesos que transcurren con absorción de calor, por lo que aumenta la temperatura. Son procesos llamados progresivos.
Solidificación, condensación, licuación y sublimación inversa son procesos en los que se libera calor, por lo que desciende la temperatura. Son procesos llamados regresivos.
Fusión, evaporación, ebullición y sublimación son procesos que transcurren con absorción de calor, por lo que aumenta la temperatura. Son procesos llamados progresivos.
Solidificación, condensación, licuación y sublimación inversa son procesos en los que se libera calor, por lo que desciende la temperatura. Son procesos llamados regresivos.
Mientras se produce el cambio de estado la temperatura del cuerpo no cambia. Todo el calor aportado se invierte en el cambio de estado. Lo mismo ocurre si el cambio es regresivo. Entonces, el calor se desprende y la temperatura de la sustancia tampoco varía hasta que acaba el cambio de estado físico.


ANIMACIONES
5. CLASIFICACIÓN DE LA MATERIA
La materia puede encontrarse en la naturaleza como sustancia pura o formando mezclas. Como la Química trata de estudiar la materia y sus transformaciones, a continuación te vamos a presentar unos conceptos sobre las distintas clases de materias que hay y las diferencias que existen entre ellas:
La materia puede encontrarse en la naturaleza como sustancia pura o formando mezclas. Como la Química trata de estudiar la materia y sus transformaciones, a continuación te vamos a presentar unos conceptos sobre las distintas clases de materias que hay y las diferencias que existen entre ellas:
- Fase: Es una porción de materia física y químicamente uniforme. Es un concepto distinto al de estado, por ejemplo, una mezcla de líquido y aceite está constituida por dos fases a pesar de ser las dos sustancias líquidas.
- Una Fase: La sustancias formadas por una sola fase pueden ser de dos tipos: sustancias puras o disoluciones (también llamadas mezclas homogéneas.
- Más de una fase: Cuando una mezcla está formada por más de una fase se denomina mezcla heterogénea. Las mezclas heterogéneas se pueden separar en sus distintas fases por métodos físicos o mecánicos (filtración, decantación, …).
El estudio de las mezclas heterogéneas puede simplificarse analizando cada una de sus fases por separado, de ahí que no las estudiemos con profundidad y pasemos a detallar las mezclas homogéneas y las sustancias puras.
6. SUSTANCIAS CONSTITUIDAS POR UNA SOLA FASE
Las hay de dos tipos:
6.1. Disoluciones: Son mezclas homogéneas en las que sus componentes pueden separarse por métodos físicos (calentamiento, destilación, …). Hay varios tipos de ellas:
6. SUSTANCIAS CONSTITUIDAS POR UNA SOLA FASE
Las hay de dos tipos:
6.1. Disoluciones: Son mezclas homogéneas en las que sus componentes pueden separarse por métodos físicos (calentamiento, destilación, …). Hay varios tipos de ellas:
- Sólidas: Aleaciones (por ejemplo el acero (Fe y C).
- Líquidas: Sales disueltas.
- Gaseosas: por ejemplo el aire (mezcla de gases, fundamentalmente oxígeno y nitrógeno).
6.2. Sustancias puras: Las hay de dos tipos:
- Elementos: Sustancias que no se pueden separar en otras más sencillas. Hay 109 elementos organizados convenientemente en la Tabla periódica).
- Compuestos: Son sustancias puras que se pueden descomponer en otras más sencillas. Están formadas por la agrupación de varios elementos. Tienen las siguientes características:
- Composición fija e invariable, independientemente de su procedencia, (por ejemplo, el agua siempre tendrá un 88,89 % de oxígeno y un 11,11 % de hidrógeno).
- Tienen propiedades que las diferencian (al igual que los elementos) como puntos de fusión y ebullición, densidad, …
- Son siempre homogéneas, aunque todas las sustancias homogéneas no son compuestos o elementos (sustancias puras), también están las disoluciones.
- En las mezclas los componentes mantienen sus propiedades, mientras que en los compuestos no.
En ocasiones existen verdaderas dificultades para poder diferenciar una disolución de un compuesto, por eso, el la siguiente tabla te resumimos las diferencias fundamentales:
|
A continuación te proponemos un algoritmo para que puedas clasificar cualquier sustancia según el tipo que sea: mezcla (homogénea o heterogénea) o sustancia pura (elemento o compuesto).
7. CAMBIOS FÍSICOS Y QUÍMICOS
En la naturaleza se producen continuamente cambios o transformaciones. Vamos a clasificar estos cambios en dos tipos: químicos y físicos.
Cambios químicos: Son aquellos en los que unas sustancias se transforman en otras sustancias diferentes, con naturaleza y propiedades distintas. Por ejemplo se producen cambios químicos cuando una sustancia arde, se oxida o se descompone.
Cambios físicos: Son todos aquellos en los que ninguna sustancia se transforma en otra diferente. Por ejemplo se producen cambios físicos cuando una sustancia se mueve, se le aplica una fuerza o se deforma. Ejemplos de procesos físicos son: evaporación, fusión, destilación, filtración, …
ACTIVIDAD
Cambios químicos: Son aquellos en los que unas sustancias se transforman en otras sustancias diferentes, con naturaleza y propiedades distintas. Por ejemplo se producen cambios químicos cuando una sustancia arde, se oxida o se descompone.
Cambios físicos: Son todos aquellos en los que ninguna sustancia se transforma en otra diferente. Por ejemplo se producen cambios físicos cuando una sustancia se mueve, se le aplica una fuerza o se deforma. Ejemplos de procesos físicos son: evaporación, fusión, destilación, filtración, …
|
ACTIVIDAD
8. MAGNITUDES MÁSICAS
8.1. Masa atómica
Los átomos, al tener una masa muy pequeña, deben de medirse en una unidad de masa muy pequeña. Por ello, se define la llamada unidad de masa atómica (uma) que es la doceava parte de la masa del isótopo de carbono 12 (1 uma = masa del carbono -12/12).
Lo que se hace es medir la masa de todos los elementos en uma. Para ello, se compara la masa de cualquier elemento con la masa del carbono-12 dividida entre 12. Por ejemplo, la masa del hidrógeno es 1 uma, lo que indica que su masa es la misma que la del carbono -12 dividida entre 12. Otro ejemplo, la masa del helio es 4 uma, lo que indica que su masa es cuatro veces mayor que la del carbono -12 dividida entre 12.
Las masas atómicas de los elementos están calculadas y aparecen en la Tabla Periódica, por lo que no hay que calcularlas.
8.1. Masa atómica
Los átomos, al tener una masa muy pequeña, deben de medirse en una unidad de masa muy pequeña. Por ello, se define la llamada unidad de masa atómica (uma) que es la doceava parte de la masa del isótopo de carbono 12 (1 uma = masa del carbono -12/12).
Lo que se hace es medir la masa de todos los elementos en uma. Para ello, se compara la masa de cualquier elemento con la masa del carbono-12 dividida entre 12. Por ejemplo, la masa del hidrógeno es 1 uma, lo que indica que su masa es la misma que la del carbono -12 dividida entre 12. Otro ejemplo, la masa del helio es 4 uma, lo que indica que su masa es cuatro veces mayor que la del carbono -12 dividida entre 12.
Las masas atómicas de los elementos están calculadas y aparecen en la Tabla Periódica, por lo que no hay que calcularlas.
Vamos a ver con un ejemplo cómo se determinan las masas relativas medias para un elemento como el Carbono:
El Carbono es una mezcla de tres isótopos:
| C12 = 12 u.m.as 98'9% |
| C13 = 13 u.m.as 1'1% |
| C14 = 14 u.m.as 0'0% |
¿Cuál es el peso atómico del Carbono natural?
no hay ningún átomo de C que pese 12'01 u.m.as, es una media ponderada y este es el valor que aparece en la tabla periódica.
8.2. Masa molecular
Los elementos químicos se pueden unir mediante enlaces químicos formado moléculas. Para calcular la masa molecularde un compuesto se suma la masa en uma de cada uno de sus elementos.
Ej.: Mm(H2O) = 18 uma, Mm(H2) = 2 uma, Mm(CO2) = 44 uma.
Otra posibilidad es que los elementos se unan formando sólidos. Los sólidos (que están formados por muchos átomos) se representan mediante una fórmula que indica la proporción en la que participan los diferentes elementos en el compuesto (masa fórmula).
Otra posibilidad es que los elementos se unan formando sólidos. Los sólidos (que están formados por muchos átomos) se representan mediante una fórmula que indica la proporción en la que participan los diferentes elementos en el compuesto (masa fórmula).
Ejemplo: la masa formula del NaCl (sólido iónico) se calcula sumando la masa del sodio (23 uma) y la del cloro (35,5 uma), por tanto es de 58,5 uma.
A efectos prácticos la masa de moléculas y sólidos se hace de la misma forma, sumando la masa de los elementos de su fórmula.
A efectos prácticos la masa de moléculas y sólidos se hace de la misma forma, sumando la masa de los elementos de su fórmula.
Actualmente se define:
8.3. Masa atómica gramo
Para medir la masa de los átomos, al ser muy pequeña, utilizamos una unidad muy pequeña, la uma. Con ella medimos la masa de todos los elementos de la Tabla Periódica.
Sin embargo, esta unidad, al ser tan pequeña, no es una unidad práctica para usar en laboratorio. Por ello, los científicos han elaborado una lista de masas atómicas en gramos. Es decir, han cogido la lista de masas atómicas en uma, han dejado los mismos números, pero han cambiado la unidad uma por otra mucho más grande, el gramo.
Cuando expresamos la masa atómica en uma nos referimos a la masa de un átomo de ese elemento. Cuando expresamos la masa atómica en gramos, tenemos que coger muchos átomos de ese elemento (más adelante veremos cuantos) y se dice que tenemos un mol de átomos del mismo.
1 gramo hay 602409638554216867469876 uma. Se puede ver que un gramo contiene muchas uma.
8.4. Masa molecular gramo
Igualmente que como ocurre con los átomos, la masa de una molécula es muy pequeña y también se miden en uma.
De igual manera, y por cuestiones prácticas la masa de las moléculas se expresa en gramos. Cuando expresamos la masa molecular en uma nos referimos a la masa de una molécula. Cuando expresamos la masa molecular en gramos, tenemos que coger muchas moléculas de ese compuesto o elemento (más adelante veremos cuantas) y se dice que tenemos un mol de moléculas de la misma.
Las masas molares de una molécula se calculan sumando las masas molares de todos y cada uno de los átomos que forman parte de la molécula del compuesto o elemento.
Para medir la masa de los átomos, al ser muy pequeña, utilizamos una unidad muy pequeña, la uma. Con ella medimos la masa de todos los elementos de la Tabla Periódica.
Sin embargo, esta unidad, al ser tan pequeña, no es una unidad práctica para usar en laboratorio. Por ello, los científicos han elaborado una lista de masas atómicas en gramos. Es decir, han cogido la lista de masas atómicas en uma, han dejado los mismos números, pero han cambiado la unidad uma por otra mucho más grande, el gramo.
Cuando expresamos la masa atómica en uma nos referimos a la masa de un átomo de ese elemento. Cuando expresamos la masa atómica en gramos, tenemos que coger muchos átomos de ese elemento (más adelante veremos cuantos) y se dice que tenemos un mol de átomos del mismo.
1 gramo hay 602409638554216867469876 uma. Se puede ver que un gramo contiene muchas uma.
8.4. Masa molecular gramo
Igualmente que como ocurre con los átomos, la masa de una molécula es muy pequeña y también se miden en uma.
De igual manera, y por cuestiones prácticas la masa de las moléculas se expresa en gramos. Cuando expresamos la masa molecular en uma nos referimos a la masa de una molécula. Cuando expresamos la masa molecular en gramos, tenemos que coger muchas moléculas de ese compuesto o elemento (más adelante veremos cuantas) y se dice que tenemos un mol de moléculas de la misma.
Las masas molares de una molécula se calculan sumando las masas molares de todos y cada uno de los átomos que forman parte de la molécula del compuesto o elemento.
8.5. Concepto de mol
El número 6,02. 10 23 es muy importante en química. Recibe el nombre de Número o Constante de Avogadro (NA)
Es el número de átomos de C que hay que reunir para que su masa sea igual a 12,0 g (el valor de la masa atómica en gramos). Por tanto:
Masa de 1 átomo de C: 12,0 u
Observa que un átomo de H tiene una masa 12 veces inferior a uno de C.
Si ahora tomamos 6,02.1023 átomos de C y el mismo número de átomos de H, resultará que éstos tendrán una masa 12 veces menor:
Si repetimos este razonamiento para otros átomos llegaríamos a idénticas conclusiones:
Y lo mismo pasaría si extendemos el razonamiento a moléculas:
Se define el mol como la cantidad de sustancia que contiene 6,02.1023 unidades elementales.
Cuando se usa el mol las unidades elementales deben ser especificadas, pudiendo ser átomos, moléculas, iones…
El mol es la unidad de cantidad de materia del Sistema Internacional de Unidades (S.I.)
La masa de un mol en gramos es igual al valor de la masa atómica o molecular.
Es el número de átomos de C que hay que reunir para que su masa sea igual a 12,0 g (el valor de la masa atómica en gramos). Por tanto:
Masa de 1 átomo de C: 12,0 u
Masa de 6,02.1023 átomos de C: 12,0 g
Comparemos ahora las masas de un átomo de C y uno de H:
Masa de 1 átomo de C : 12 u
Masa de 1 átomo de H: 1 u
Observa que un átomo de H tiene una masa 12 veces inferior a uno de C.
Si ahora tomamos 6,02.1023 átomos de C y el mismo número de átomos de H, resultará que éstos tendrán una masa 12 veces menor:
Masa de 6,02.1023 átomos de C: 12,0 g
Masa de 6,02.1023 átomos de H: 1,0 g
Si repetimos este razonamiento para otros átomos llegaríamos a idénticas conclusiones:
Masa de 6,02.1023 átomos de O: 16,0 g
Masa de 6,02.1023 átomos de N: 14,0 g
Y lo mismo pasaría si extendemos el razonamiento a moléculas:
Masa de 6,02.1023 moléculas de H2O : 18,0 g
Masa de 6,02.1023 moléculas de CO2 : 44,0 g
Se define el mol como la cantidad de sustancia que contiene 6,02.1023 unidades elementales.
Cuando se usa el mol las unidades elementales deben ser especificadas, pudiendo ser átomos, moléculas, iones…
El mol es la unidad de cantidad de materia del Sistema Internacional de Unidades (S.I.)
La masa de un mol en gramos es igual al valor de la masa atómica o molecular.
8.6. Definiciones de mol
Mol es la cantidad de materia que contiene un número de entidades
igual al número de átomos contenidos en 12 g de carbono
Mol es la cantidad de materia que contiene el número de Avogadro,
N, de partículas unitarias o entidades fundamentales (ya sean éstas
moléculas, átomos, iones, electrones, etc.).
La masa de un mol de cualquier sustancia es el número de gramos
de esa sustancia igual en valor a su masa molecular. A esta masa se la
denomina Masa molar y se mide en g/mol.
9. DISOLUCIONES
Una disolución, también llamada solución, es una mezcla homogénea a nivel molecular o iónico de dos o más sustancias químicas, que no reaccionan entre sí, cuyos componentes se encuentran en proporción que varía entre ciertos límites. El tamaño molecular de la partículas debe ser inferior a 10-9 m.
Se llama mezcla coloidal cuando el tamaño de partícula va de 10-9 m a 2.10-7 m.
Se llama suspensión cuando el tamaño de las partículas es del orden de 2.10-7 m.
9.1. Componentes de una disolución: Soluto y disolvente
Frecuentemente, uno de los componentes es denominado solvente, disolvente, dispersante o medio de dispersión y los demás solutos. Los criterios para decidir cuál es el disolvente y cuáles los solutos son más o menos arbitrarios; no hay una razón científica para hacer tal distinción. Se suele llamar solvente al componente que tiene el mismo estado de agregación que la disolución; y soluto o solutos, al otro u otros componentes. Si todos tienen el mismo estado, se llama disolvente al componente que interviene en mayor proporción de masa, aunque muchas veces se considera disolvente al que es más frecuentemente usado como tal.
Según el número de componentes:
- Binarias
- Ternarias
Según estado físico de soluto y disolvente:
Según la proporción de los componentes:
- Disolución diluida: es aquella en donde la cantidad de soluto que interviene está en mínima proporción en un volumen determinado.
- Disolución concentrada: tiene una cantidad considerable de soluto en un volumen determinado.
- Disolución insaturada: no tiene la cantidad máxima posible de soluto para una temperatura y presión dadas.
- Disolución saturada: tienen la mayor cantidad posible de soluto para una temperatura y presión dadas. En ellas existe un equilibrio entre el soluto y el disolvente.
- Disolución sobresaturada: contiene más soluto del que puede existir en equilibrio a una temperatura y presión dadas. Si se calienta una solución saturada se le puede agregar más soluto; si esta solución es enfriada lentamente y no se le perturba, puede retener un exceso de soluto pasando a ser una solución sobresaturada. Sin embargo, son sistemas inestables, con cualquier perturbación el soluto en exceso precipita y la solución queda saturada; esto se debe a que se mezclaron.
Algunas formas de expresar la concentración son:
- % en masa. Cantidad en gramos de soluto por cada 100 gramos de disolución.
- % en volumen. Cantidad en mililitros de soluto por cada 100 mililitros de disolución.
- g/L. Cantidad en gramos de soluto por cada litro (1000 mililitros) de disolución.
- Molaridad. Número de moles de soluto por cada litro de disolución (moles/litro).
9.2. Concentración
En la vida diaria expresamos la concentración de tres maneras diferentes: Concentración en masa entre volumen (es la forma de expresar la concentración en muchos etiquetados, por ejemplo en las aguas minerales), Concentración en tanto por ciento en masa (también es frecuente en el etiquetado) y Concentración en tanto por ciento en volumen (el grado alcohólico de las bebidas es una concentración de este tipo)
Concentración en masa / volumen
|
Concentración en tanto por ciento en masa
|
Concentración en tanto por ciento en volumen
|
En el ámbito de la química expresamos la concentración también de tres maneras diferentes: Molaridad (la más frecuente), Molalidad (se usa en propiedades coligativas como el aumento ebulloscópico o el descenso crioscópico) y Fracción molar (se usa en la Ley de Raoult y en el cálculo de las presiones parciales).
Molaridad
| Molalidad |
| Fracción molar |
Preparar disoluciones es una de las tareas fundamentales en todo laboratorio de química. ¿Cómo se preparan? el siguiente vídeo te puede ayudar.
Pero para preparar una disolución tenemos que hacer cálculos: de la masa de soluto si es un soluto sólido o del volumen de disolución si el soluto está en forma de disolución concentrada, como pasa con los ácidos de laboratorio.
A) Masa de soluto que precisamos para preparar una disolución.
Masa de soluto
|
B) Volumen de disolución concentrada que precisamos para preparar una disolución.
Volumen de disolución
|
9.3. Resumen de las formas de expresar la concentración
Concentración en gramos/litro. Expresa la masa en gramos de soluto por cada litro de disolución.
Tanto por ciento en masa. Expresa la masa en gramos de soluto por cada 100 g de disolución.
Tanto por ciento en volumen. Expresa la masa en cm3 de soluto por cada 100 cm3 de disolución.
Molaridad. Expresa el número de moles de soluto por cada litro de disolución.
Fracción molar. Expresa la proporción en que se encuentran los moles de soluto con respecto a los moles totales de disolución.
ANIMACIONES







Moléculas y luz (PhET)
10. NOTACIÓN DE LAS REACCIONES
Los cambios químicos se representan o escriben mediante lo que denominamos como ecuación química.
En una ecuación química los reactivos se escriben a la izquierda y los productos a la derecha y en medio una flecha.
Los cambios químicos se representan o escriben mediante lo que denominamos como ecuación química.
En una ecuación química los reactivos se escriben a la izquierda y los productos a la derecha y en medio una flecha.
Hemos comentado que en las reacciones químicas los reactivos desaparecen y se convierten en productos. También puede pasar que los productos se conviertan de nuevo en los reactivos. Por tanto se producen dos procesos químicos simultáneamente, uno en el que los reactivos se convierten en productos y otro en sentido contrario en el que los productos se convierten en reactivos. Cuando esto sucede se dice que estamos en una situación de equilibrio químico.
10.1 Justificación del ajuste químico
Dado que los átomos se conservan en las reacciones químicas, debe haber el mismo número y tipo de átomos en los reactivos y en los productos.
Ajustar una reacción consiste en colocar unos "números" delante de cada una de las fórmulas de los reactivos y productos, llamados coeficientes estequiométricos, que multiplican el valor del número de átomos del compuesto al que precede.
Dicho con otras palabras, el coeficiente estequiométrico de un compuesto indica cuantas veces está presente ese compuesto en la reacción química.
Existen fundamentalmente dos métodos de ajustes de reacciones: el método de tanteo y el de los coeficientes indeterminados.
La siguiente reacción está sin ajustar, en la zona de los reactivos tenemos cuatro átomos de C y en los productos solo uno:
Para ajustarla tenemos que buscar los coeficientes que logran que el número de átomos de cada elemento sea igual en los reactivos que en los productos:
2 CO(g) + O2(g) ---------- 2 CO2(g)
2 HgO(s) ------------- 2 Hg(l) + O2(g)
2 HCl(ac) + Zn(s) ------------ ZnCl2(ac) + H2(g)
10.1.1. Método de ajuste por tanteo
Este método consiste en probar con diferentes valores para los coeficientes estequiométricos hasta que se cumpla que haya el mismo número de átomos de cada tipo en productos y reactivos.
Una reacción puede estar ajustada para diferentes valores de los coeficientes estequiométricos. Los coeficientes también pueden tener valores fraccionarios.
Normalmente se ajustan las reacciones dando el menor valor posible a los coeficientes, evitando los coeficientes fraccionarios.
10.1.2. Método de los coeficientes indeterminados
En este método seguimos estos pasos:
1. Cada uno de los coeficientes se considera una incógnita que se representa con una letra.
2. Se construye una ecuación para cada elemento químico, con ello s e construye un sistema de ecuaciones que tendrá tantas ecuaciones como elementos químicos diferentes tenga la reacción química.
3. Se asigna un valor arbitrario (el que se quiera) a cualquiera de los coeficientes. Normalmente se procura que sea uno sencillo.
4. Se resuelve el sistema de ecuaciones, y se coloca en la reacción química el valor de los coeficientes calculados. Si se desea se puede simplificar el resultado dividiendo todos los coeficientes por un mismo valor.
Existen varios métodos para ajustar ecuaciones químicas. Se empleará el de los coeficientes variables. Para ello, se asigna una incógnita a cada una de las fórmulas que aparecen en la ecuación química. Por ejemplo, en la reacción entre el trioxocarbonato(IV) de sodio y el cloruro de hidrógeno, que produce cloruro de sodio, agua y dióxido de carbono:
En este método seguimos estos pasos:
1. Cada uno de los coeficientes se considera una incógnita que se representa con una letra.
2. Se construye una ecuación para cada elemento químico, con ello s e construye un sistema de ecuaciones que tendrá tantas ecuaciones como elementos químicos diferentes tenga la reacción química.
3. Se asigna un valor arbitrario (el que se quiera) a cualquiera de los coeficientes. Normalmente se procura que sea uno sencillo.
4. Se resuelve el sistema de ecuaciones, y se coloca en la reacción química el valor de los coeficientes calculados. Si se desea se puede simplificar el resultado dividiendo todos los coeficientes por un mismo valor.
Existen varios métodos para ajustar ecuaciones químicas. Se empleará el de los coeficientes variables. Para ello, se asigna una incógnita a cada una de las fórmulas que aparecen en la ecuación química. Por ejemplo, en la reacción entre el trioxocarbonato(IV) de sodio y el cloruro de hidrógeno, que produce cloruro de sodio, agua y dióxido de carbono:
a Na2CO3 + b HCl  c NaCl + d CO2 + e H2O
c NaCl + d CO2 + e H2O
Na . a · 2 = c · 1
C . a · 1 = d · 1
O . a · 3 = d · 2 + e · 1
H . b · 1 = e · 2
Cl . b · 1 = c · 1
Para cada elemento se establece una ecuación, que iguala los átomo de ese elemento en los reactivos y en los productos:
Aparece un sistema indeterminado que hay que resolver. Se resuelve por tanteo, asignando, a una de las incógnitas, un valor.
Aparece un sistema indeterminado que hay que resolver. Se resuelve por tanteo, asignando, a una de las incógnitas, un valor.
Si se hace que b = 2, resulta e = 1, c = 2, a = 1 y d = 1. La ecuación es:
Na2CO3 + 2·HCl  2·NaCl + CO2 + H2O
2·NaCl + CO2 + H2O
Resumen de relaciones estequiométricas
- Toda reacción química debe estar ajustada.
- Las relaciones molares en una reacción química vienen dados por los coeficientes estequiométricos.
- El número de moléculas está relacionado con el número de moles mediante el número de Avogadro.
- El número de moles y la masa de las sustancias están relacionados mediante la masa molar.
- En el caso de gases ideales, el volumen de estos se relacionan con los moles a través de la ecuación general de los gases ideales.
Ejemplos
1. Ajusta las siguientes ecuaciones químicas, usando el applet e indica el tipo de reacción de cada una:
a) C8H18 + O2 ® CO2 + H2O
b) CaCO3 + HCl ® CaCl2 + CO2 + H2O
c) Zn + H2SO4 ® ZnSO4 + H2
d) NaCl + MnO2 + H2SO4 ® MnSO4 + Na2SO4 + Cl2 + H2O
e) PbS + H2O2 ® PbSO4 + H2O
f) HCl + K2Cr2O7 ® Cl2 + CrCl3 + KCl + H2O
g) NH3 + O2 ® NO + H2O
h) Sn + HNO3 ® SnO2 + NO2 + H2O
i) HI + HNO3 ® NO + H2O + I2
j) KMnO4 + HCl ® MnCl2 + KCl + Cl2 + H2O
2. Indica si las ecuaciones químicas siguientes corresponden a reacciones de síntesis, de descomposición o desplazamiento y ajústalas:
a) HCl (ac) + Al(OH)3 (s) ® AlCl3 (ac) + H2O (l)
b) Fe (s) + CuSO4 (ac) ® Cu (s) + FeSO4 (ac)
c) HgO (s) ® Hg (s) + O2 (g)
d) SO2 (g) + O2 (g) ® SO3 (g)
e) H2S (ac) + O2 (g) ® S (s) + H2O (l)
f) NH3 (g)+ Mg (s) ® Mg3N2 (s)+ H2 (g)
3. Completa y ajusta mediante el applet las siguientes ecuaciones químicas:
a) CaO + H2O ® ...........
b) Zn + HCl ® ......... + .........
c) Al + H2SO4 ® ........ + .........
d) C5H10 + O2 ® ......... + .........
e) Ca(OH)2 + HCl ® ....... + .........
f) Mg(OH)2 + HNO3 ® ........ + .......
g) H2SO4 + Ba(OH)2 ® ......... + .........
h) Ag2O ® ........ + ........
i) ZnO + C ® ....... + ......
j) CH3COOH + CH3CH2CH2OH ® ............................... + .........
ANIMACIONES












11. MECANISMOS DE REACCIÓN
Hemos comentado que en las reacciones químicas se producen procesos de ruptura y formación de enlaces químicos.
La descripción detallada de todo el proceso, que a nivel atómico se produce durante una reacción química, se conoce con el nombre de mecanismo de reacción.
Por tanto, el mecanismo de una reacción no es más que explicar con el mayor detalle posible como se producen los cambios de los reactivos para llegar a los productos. Esto implica indicar la posición de los átomos y la formación y ruptura de los enlaces a lo largo del proceso de reacción.
Actualmente la forma de determinar los mecanismos de reacción es mediante experimentos de laboratorio (de energía, de velocidad de reacción, de detección de intermedios, etc.) y/o mediante cálculos computacionales empleando principios de la llamada química teórica. De todas formas se considera que es imposible conocer un mecanismo con una seguridad total.
Los mecanismos se clasifican en dos grandes grupos:
- Mecanismos elementales o concertados: son aquellos en los que los reactivos se convierten directamente en productos sin que se forme entremedio ninguna otra especie química.
- Mecanismos por etapas o complejas: en este caso los reactivos no se transforma directamente en productos sino que se transforman en "intermedios de reacción" que a su vez se transforman en los productos.
- Unimoleculares: Sólo participa una molécula.
- Bimoleculares: Participan 2 moléculas.
- Trimoleculares: Participan 3 moléculas.
11.1. Teoría de colisiones
La teoría de colisiones es un modelo para explicar los mecanismos de las reacciones químicas.
Según esta teoría para que se produzca una reacción deben cumplirse tres condiciones:


La teoría de colisiones permite explicar los siguientes aspectos de las reacciones químicas:

Esta teoría también presenta algunas limitaciones, por ejemplo:
Como hemos comentado los reactivos deben de chocar con una orientación adecuada y con energía suficiente para que los reactivos se transformen en productos. A la energía mínima necesaria que los reactivos deben de tener para que la colisión sea eficaz se le denomina energía de activación.
Cuando las moléculas de los reactivos están colisionando con la orientación adecuada y con la energía activación necesaria, se encuentra una especie característica en la que se están rompiendo y formando enlaces químicos, se le denomina estado de transición.
Un ejemplo de la energía de activación puede ser el siguiente. Aunque pongamos la madera en la chimenea por sí sola no prenderá. Lo mismo ocurre con una cerilla o un mechero. Si pulsamos la palanca del mechero, el gas sale de su depósito, pero no arde.
Para que una reacción comience necesita energía, energía de activación. Por eso para que la cerilla prenda debemos frotarla con el rascador de la caja de cerillas. Así la cerilla se calienta y el combustible de su cabeza prende, ese calor suministrado con el frotamiento es la energía de activación.
La teoría de colisiones es un modelo para explicar los mecanismos de las reacciones químicas.
Según esta teoría para que se produzca una reacción deben cumplirse tres condiciones:
- Las moléculas de los reactivos tienen que chocar entre sí.
- Estos choques deben de producirse con energía suficiente de forma que se puedan romper y formar enlaces químicos.
- En el choque debe haber una orientación adecuada para que los enlaces que se tienen que romper y formar estén a una distancia y posición viable.
- A continuación se ponen dos ejemplos esquemáticos de como podrían ser según la teoría de colisiones dos reacciones químicas.
La teoría de colisiones permite explicar los siguientes aspectos de las reacciones químicas:
- Posible mecanismo de transformación de reactivos en productos.
- Ley de conservación de la masa.
- Energía de reacción.
- Velocidad de reacción.
- Independencia entre la energía y la velocidad de reacción.

Esta teoría también presenta algunas limitaciones, por ejemplo:
- Hay reacciones unimoleculares en las que un reactivo se descompone "sin chocar".
- Algunas reacciones complejas no se explican bien con esta teoría.
Como hemos comentado los reactivos deben de chocar con una orientación adecuada y con energía suficiente para que los reactivos se transformen en productos. A la energía mínima necesaria que los reactivos deben de tener para que la colisión sea eficaz se le denomina energía de activación.
Cuando las moléculas de los reactivos están colisionando con la orientación adecuada y con la energía activación necesaria, se encuentra una especie característica en la que se están rompiendo y formando enlaces químicos, se le denomina estado de transición.
Un ejemplo de la energía de activación puede ser el siguiente. Aunque pongamos la madera en la chimenea por sí sola no prenderá. Lo mismo ocurre con una cerilla o un mechero. Si pulsamos la palanca del mechero, el gas sale de su depósito, pero no arde.
Para que una reacción comience necesita energía, energía de activación. Por eso para que la cerilla prenda debemos frotarla con el rascador de la caja de cerillas. Así la cerilla se calienta y el combustible de su cabeza prende, ese calor suministrado con el frotamiento es la energía de activación.
12. RELACIÓN ENTRE ENERGÍA Y VELOCIDAD DE REACCIÓN
La velocidad de una reacción no está relacionada directamente con su energía de reacción. Una reacción puede ser rápida y ser exotérmica o endotérmica y viceversa.
La energía de reacción se obtiene de restar la energía de los enlaces que se rompen a la energía de los enlaces que se forman.
La velocidad está relacionada con la facilidad o dificultad para romper los enlaces.
Ambos factores no están directamente relacionados, por lo que no se puede establecer relación entre energía y velocidad.
Cuando se produce una reacción química, los enlaces que unen los átomos deben romperse y formarse otros nuevos. Las moléculas se rompen y se forman moléculas nuevas, diferentes de las que había anteriormente.
Para poder romper los enlaces existentes, es necesario suministrar una energía, la energía de activación, que permite que la transformación química comience.
Si los productos de la reacción tienen menos energía que los reactivos, variación de energía < 0, la propia reacción producirá energía y continuará por sí sola: es una reacción exotérmica. Pero para iniciarla seguirá siendo necesario suministrar la energía de activación. Así, para encender una cerilla, basta frotarla con el rascador. Una vez iniciada la combustión, ésta continuará, pero se necesita frotar para que la cerilla encienda.
Si los productos tienen más energía que los reactivos, variación de energía > 0, la reacción no produce energía, sino que la consume y es necesario suministrar energía constantemente para que la reacción tenga lugar, en caso contrario, se detiene: es una reacción endotérmica. Por eso, al cocinar, se debe mantener los alimentos sobre el fuego, en el momento en que dejan de calentarse, la reacción se detiene y los alimentos quedan crudos.
CH4 + 2 O2 --------------------------- CO2 + 2 H2O + 875 kJ (Proceso exotérmico)


La energía de reacción se obtiene de restar la energía de los enlaces que se rompen a la energía de los enlaces que se forman.
La velocidad está relacionada con la facilidad o dificultad para romper los enlaces.
Ambos factores no están directamente relacionados, por lo que no se puede establecer relación entre energía y velocidad.
Cuando se produce una reacción química, los enlaces que unen los átomos deben romperse y formarse otros nuevos. Las moléculas se rompen y se forman moléculas nuevas, diferentes de las que había anteriormente.
Para poder romper los enlaces existentes, es necesario suministrar una energía, la energía de activación, que permite que la transformación química comience.
Si los productos de la reacción tienen menos energía que los reactivos, variación de energía < 0, la propia reacción producirá energía y continuará por sí sola: es una reacción exotérmica. Pero para iniciarla seguirá siendo necesario suministrar la energía de activación. Así, para encender una cerilla, basta frotarla con el rascador. Una vez iniciada la combustión, ésta continuará, pero se necesita frotar para que la cerilla encienda.
Si los productos tienen más energía que los reactivos, variación de energía > 0, la reacción no produce energía, sino que la consume y es necesario suministrar energía constantemente para que la reacción tenga lugar, en caso contrario, se detiene: es una reacción endotérmica. Por eso, al cocinar, se debe mantener los alimentos sobre el fuego, en el momento en que dejan de calentarse, la reacción se detiene y los alimentos quedan crudos.
El calor absorbido o desprendido puede añadirse a la ecuación química como un elemento más del proceso:
CH4 + 2 O2 --------------------------- CO2 + 2 H2O + 875 kJ (Proceso exotérmico)
2 KClO3 + 89,4 (kJ) ---------------------------- 2 KCl + 3 O2 (Proceso endotérmico)
Una reacción química ajustada nos da, por tanto, la siguiente información:


13. PROPIEDADES DE LAS REACCIONES QUÍMICAS
13.1. Conservación de la masa
Si tuviéramos que decidir cuál es la ley o principio más importante en el campo de la Química no cabría ninguna duda, el principio de consevación de la masa o ley de Lavoisier. Y no por su complejidad, que no tiene ninguna, sino porque su establecimiento, a finales del siglo XVIII, marcó el nacimiento de la química moderna y el abandono de su predecesora, la alquimia. y por ello a su autor, el francés Antoine-Laurent Lavoisier ( 1743-1794) se le conoce como el padre de la química.Se puede enunciar de distintas formas:
La materia ni se crea ni se destruye, sólo se transforma.
En una reacción química la suma de la masa de los reactivos es igual a la suma de la masa de los productos.
En una reacción química los átomos no desaparecen, simplemente se ordenan de otra manera.
Aunque te pueda parecer muy lógica y sensata esta idea, y que no tiene mucho mérito haber llegado a esa conclusión, Lavoisier tuvo que realizar numerosos y meticulosos experimentos para convencer a los que por entonces pensaban que al calentar un metal este ganaba masa cuando se convertía en una nueva sustancia. Lavoisier midió en un recipiente cerrado las masas del sólido y el aire antes y después de la combustión y llegó a la conclusión de quela masa que ganaba el metal era igual a la masa de aire que se perdía.

13.2. Hipótesis de Avogadro
Los gases ideales cumplen la hipótesis de Avogadro que establece que "una cantidad de cualquier tipo de gas, en un mismo volumen, a la misma temperatura y la misma presión, contiene el mismo número de moléculas, independientemente del tipo de gas que sea".
En condiciones normales (0ºC y 1 atm), 1 mol de gas ideal (que contiene NA moléculas), ocupa 22,4 litros, independientemente del tipo de gas que haya dentro del recipiente.
En un mol de cualquier sustancia siempre hay el mismo número de moléculas. Este número se llama número de Avogadro (NA) y es de 6,023. 1023
NA = 6.022 141 39 × 1023
El volumen de un gas ideal en unas determinadas condiciones de presión y temperatura, se calcula a través de la ecuación general de los gases ideales.
Avogadro también supuso que en la mayoría de los elementos gaseosos, sus moléculas están formadas por la unión de dos átomos, es decir, son moléculas diatómicas.
Todo ello permitió deducir algunas fórmulas para compuestos gaseosos. Veamos algunos ejemplos:
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Hoy se sabe que salvo en gases nobles, los elementos gaseosos están agrupados en moléculas diatómicas, es decir, están formados por la unión de dos átomos (H2, O2, N2, F2, Cl2, Br2, I2, ...)
ANIMACIONES
Cuando dos o más elementos se combinan para formar un determinado compuesto lo hacen en una relación en peso constante independientemente del proceso seguido para formarlo.
Esta ley también se puede enunciar desde otro punto de vista
Para cualquier muestra pura de un determinado compuesto los elementos que lo conforman mantienen una proporción fija en peso, es decir, una proporción ponderal constante.
Así, por ejemplo, en el agua los gramos de hidrógeno y los gramos de oxígeno están siempre en la proporción 1/8, independientemente del origen del agua.
Estos delicados análisis fueron realizados sobre todo por el químico sueco BERZELIUS (1779 - 1848). No obstante, será el francés PROUST, en 1801, quien generalice el resultado enunciando la ley a la que da nombre.
Esta ley también se puede enunciar desde otro punto de vista
Para cualquier muestra pura de un determinado compuesto los elementos que lo conforman mantienen una proporción fija en peso, es decir, una proporción ponderal constante.
Así, por ejemplo, en el agua los gramos de hidrógeno y los gramos de oxígeno están siempre en la proporción 1/8, independientemente del origen del agua.
Estos delicados análisis fueron realizados sobre todo por el químico sueco BERZELIUS (1779 - 1848). No obstante, será el francés PROUST, en 1801, quien generalice el resultado enunciando la ley a la que da nombre.
La ley de las proporciones definidas no fue inmediatamente aceptada al ser combatida por BERTHOLLET, el cual, al establecer que algunas reacciones químicas son limitadas, defendió la idea de que la composición de los compuestos era variable. Después, de numerosos experimentos pudo reconocerse en 1807 la exactitud de la ley de Proust.




13.4. Ley de las proporciones múltiples (o de Dalton).
Las cantidades de un mismo elemento que se unen con una cantidad fija de otro elemento para formar en cada caso un compuesto distinto están en la relación de números enteros sencillos.
La ley de Proust no impide que dos o más elementos se unan en varias proporciones para formar varios compuestos. Así, por ejemplo, el oxígeno y el cobre se unen en dos proporciones y forman dos óxidos de cobre que contienen 79,90 % y 88,83 % de cobre. Si calculamos la cantidad de cobre combinado con un mismo peso de oxígeno, tal como 1g, se obtiene en cada caso:
Las dos cantidades de cobre son, muy aproximadamente, una doble de la otra y, por tanto, los pesos de cobre que se unen con un mismo peso de oxígeno para formar los dos óxidos están en la relación de 1 es a 2.
El enunciado de la ley de las proporciones múltiples se debe a DALTON, en 1803 como resultado de su teoría atómica y es establecida y comprobada definitivamente para un gran número de compuestos por BERZELIUS en sus meticulosos estudios de análisis de los mismos.
13.5. Ley de las proporciones recíprocas (0 de Richter).
Los pesos de diferentes elementos que se combinan con un mismo peso de un elemento dado, dan la relación de pesos de estos Elementos cuando se combinan entre sí o bien múltiplos o submúltiplos de estos pesos.
Así, por ejemplo, con 1g de oxígeno se unen: 0,1260 g de hidrógeno, para formar agua; 4,4321 g de cloro, para formar anhídrido hipocloroso; 0,3753 g de carbono para formar gas carbónico, 1,0021 g de azufre, para formar gas sulfuroso, y 2,5050 g de calcio, para formar óxido cálcico. Pero los elementos hidrógeno, cloro, carbono, azufre y calcio pueden a su vez combinarse mutuamente y cuando lo hacen se encuentra, sorprendentemente, que estas cantidades, multiplicadas en algún caso por números enteros sencillos, son las que se unen entre sí para formar los correspondientes compuestos
Esta ley llamada también de las proporciones equivalentes fue esbozada por RICHTER en 1792 y completada varios años más tarde por WENZEL.
La ley de las proporciones recíprocas conduce a fijar a cada elemento un peso relativo de combinación, que es el peso del mismo que se une con un peso determinado del elemento que se toma como tipo de referencia.
Al ser el oxígeno el elemento que se combina con casi todos los demás se tomó inicialmente como tipo 100 partes en peso de oxígeno; la cantidad en peso de cada elemento que se combinaba con estas 100 partes en peso de oxígeno era su peso de combinación. El menor peso de combinación que así se encontraba era el del hidrógeno, por lo que fue natural tomar como base relativa de los pesos de combinación de los elementos el valor 1 para el hidrógeno; en esta escala el oxígeno tiene el valor 7,9365 (según las investigaciones últimamente realizadas) y otros elementos tienen también valores algo inferiores a números enteros. Pero puesto que el hidrógeno se combina con muy pocos elementos y el peso de combinación de éstos tenía que encontrarse en general a partir de su combinación con el oxígeno, se decidió finalmente tomar nuevamente el oxígeno como base de los pesos de combinación redondeando su peso tipo a 8,000; el del hidrógeno resulta ser igual a 1,008 y el de varios elementos son ahora números aproximadamente enteros.
Estos pesos de combinación se conocen hoy como pesos equivalentes. El peso equivalente de un elemento (o compuesto) es la cantidad del mismo que se combina o reemplaza -equivale químicamente- a 8,000 partes de oxígeno o 1,008 partes de hidrógeno. Se denomina también equivalente químico.
Debido a la ley de las proporciones múltiples algunos elementos tienen varios equivalentes.

 ANIMACIONES
ANIMACIONES









13.6. Ley de los volúmenes de combinación (de Gay-Lussac)
Muchos de los elementos y compuestos son gaseosos, y puesto que es más sencillo medir un volumen que un peso de gas era natural se estudiasen las relaciones de volumen en que los gases se combinan.
En cualquier reacción química los volúmenes de todas las substancias gaseosas que intervienen en la misma, medidos en las mismas condiciones de presión y temperatura, están en una relación de números enteros sencillos.
Los pesos de diferentes elementos que se combinan con un mismo peso de un elemento dado, dan la relación de pesos de estos Elementos cuando se combinan entre sí o bien múltiplos o submúltiplos de estos pesos.
Así, por ejemplo, con 1g de oxígeno se unen: 0,1260 g de hidrógeno, para formar agua; 4,4321 g de cloro, para formar anhídrido hipocloroso; 0,3753 g de carbono para formar gas carbónico, 1,0021 g de azufre, para formar gas sulfuroso, y 2,5050 g de calcio, para formar óxido cálcico. Pero los elementos hidrógeno, cloro, carbono, azufre y calcio pueden a su vez combinarse mutuamente y cuando lo hacen se encuentra, sorprendentemente, que estas cantidades, multiplicadas en algún caso por números enteros sencillos, son las que se unen entre sí para formar los correspondientes compuestos
Esta ley llamada también de las proporciones equivalentes fue esbozada por RICHTER en 1792 y completada varios años más tarde por WENZEL.
La ley de las proporciones recíprocas conduce a fijar a cada elemento un peso relativo de combinación, que es el peso del mismo que se une con un peso determinado del elemento que se toma como tipo de referencia.
Al ser el oxígeno el elemento que se combina con casi todos los demás se tomó inicialmente como tipo 100 partes en peso de oxígeno; la cantidad en peso de cada elemento que se combinaba con estas 100 partes en peso de oxígeno era su peso de combinación. El menor peso de combinación que así se encontraba era el del hidrógeno, por lo que fue natural tomar como base relativa de los pesos de combinación de los elementos el valor 1 para el hidrógeno; en esta escala el oxígeno tiene el valor 7,9365 (según las investigaciones últimamente realizadas) y otros elementos tienen también valores algo inferiores a números enteros. Pero puesto que el hidrógeno se combina con muy pocos elementos y el peso de combinación de éstos tenía que encontrarse en general a partir de su combinación con el oxígeno, se decidió finalmente tomar nuevamente el oxígeno como base de los pesos de combinación redondeando su peso tipo a 8,000; el del hidrógeno resulta ser igual a 1,008 y el de varios elementos son ahora números aproximadamente enteros.
Estos pesos de combinación se conocen hoy como pesos equivalentes. El peso equivalente de un elemento (o compuesto) es la cantidad del mismo que se combina o reemplaza -equivale químicamente- a 8,000 partes de oxígeno o 1,008 partes de hidrógeno. Se denomina también equivalente químico.
Debido a la ley de las proporciones múltiples algunos elementos tienen varios equivalentes.











13.6. Ley de los volúmenes de combinación (de Gay-Lussac)
Muchos de los elementos y compuestos son gaseosos, y puesto que es más sencillo medir un volumen que un peso de gas era natural se estudiasen las relaciones de volumen en que los gases se combinan.
En cualquier reacción química los volúmenes de todas las substancias gaseosas que intervienen en la misma, medidos en las mismas condiciones de presión y temperatura, están en una relación de números enteros sencillos.
GAY-LUSSAC formuló en 1808 la ley de los volúmenes de combinación que lleva su nombre. Al obtener vapor de agua a partir de los elementos (sustancias elementales) se había encontrado que un volumen de oxígeno se une con dos volúmenes de hidrógeno formándose dos volúmenes de vapor de agua; todos los volúmenes gaseosos medidos en las mismas condiciones de presión y temperatura.
Esta relación sencilla entre los volúmenes de estos cuerpos gaseosos reaccionantes no era un caso fortuito pues GAY-LUSSAC mostró que se cumplía en todas las reacciones en que intervienen gases tal como muestran los esquemas siguientes:
La ley no se aplica a la relación entre los volúmenes de los cuerpos sólidos y líquidos reaccionantes tal como el volumen de azufre que se une con el oxígeno para formar anhídrido sulfuroso.
ANIMACIONES
13.7. Hipótesis atómicas de Dalton
Las hipótesis atómicas fueron unas teorías emitidas por Dalton en el año 1808, tratando de explicar las tres leyes ponderales.
Las hipótesis atómicas fueron unas teorías emitidas por Dalton en el año 1808, tratando de explicar las tres leyes ponderales.
El filósofo griego Demócrito ya sostenía teorías similares, en su gran concepción, en el siglo IV a. d. C.
La teoría de Dalton puede resumirse en los siguientes puntos:
La teoría de Dalton puede resumirse en los siguientes puntos:
- La materia está compuesta por partículas indivisibles llamadas átomos: "La materia, aunque divisible en grado extremo, no lo es indefinidamente, esto es, debe haber un punto más allá del cual no se puede dividir".
- Todos los átomos de un mismo elemento son idénticos. Los átomos de distintos elementos, poseen masa y propiedades diferentes.
- Los compuestos se forman por la unión de átomos de los correspondientes elementos que lo constituyen en una relación numérica sencilla (Regla de la máxima simplicidad).
- Las reacciones químicas sólo son una reestructuración de los átomos. Los átomos se agrupan de forma diferente a como lo estaban inicialmente, pero ni se forman ni se destruyen.
Hoy se sabe que existen algunos fallos:
- Los átomos no son indivisibles, poseen electrones, protones y neutrones. En la actualidad, se han descubierto muchas más partículas subatómicas clasificadas en dos grandes grupos: los leptones y los quarks. Puedes encontrar más información en la página:
- La existencia de isótopos (átomos de un mismo elemento pero con diferente masa ya que tienen distinto número de neutrones en el núcleo).
- La Regla de la máxima simplicidad llevó a Dalton a asignar fórmulas erróneas a algunos compuestos, por ejemplo, al agua le asignó la fórmula HO y al amoniaco NH.
- En las reacciones nucleares, los átomos pueden transmutarse unos en otros emitiendo partículas radiactivas y energía.
A pesar de los errores que tiene la teoría atómica de Dalton, supuso una gran revolución para los químicos del siglo XIX planteándoles nuevos retos, entre los que podemos destacar:
- La búsqueda sistemática de nuevos elementos químicos.
- La ordenación de los elementos químicos según sus distintas propiedades, lo que condujo al Sistema periódico.
- La obtención de fórmulas químicas de compuestos.
Resumen de las leyes ponderales
1.- Ley de la conservación de la masa. - La enunció Lavoisier en 1789. - En cualquier reacción química, la suma de la masa de los productos es igual a la suma de la masa de los reactivos, es decir, que la materia no se crea ni se destruye, sólo se transforma.
2.- Ley de las proporciones definidas. - La enunció J. L. Proust en 1799. - Cuando dos elementos se combinan para formar un compuesto, lo hacen siempre en proporciones fijas y definidas, así, por ejemplo, el amoniaco siempre tiene un 82´36 % de N y un 17´64 % de H, sea cual sea su procedencia o el método utilizado para obtenerlo.
3.- Ley de las proporciones múltiples. - La enunció Dalton en 1805. - Cuando dos elementos se combinan para formar más de un compuesto, los pesos de un elemento que se combinan con una cantidad fija del otro, guardan entre sí una relación numérica sencilla.
14. TEORÍA CINÉTICO-MOLECULAR
Entre los siglos XVIII y XIX se desarrolló la teoría cinética de los gases para explicar el comportamiento de los mismos. La teoría cinético-molecular de los gases utiliza una descripción molecular para explicar el comportamiento macroscópico de la materia y se basa en postulados. Estos postulados no se pueden demostrar experimentalmente. Los aceptamos porque las consecuencias que de ellos se derivan si están de acuerdo con la experiencia.
Los postulados de la teoría cinética de los gases son los siguientes:
- Los gases consisten en Moléculas muy separadas en el espacio. El volumen real de las moléculas individuales es despreciable en comparación con el volumen total del gas como un todo (En esta teoría se considera como moléculas a las partículas que forman el gas las cuales en algunos casos son moléculas de uno o varios átomos).
- Las moléculas de los gases están en constante movimiento caótico, chocan entre sí elásticamente (no pierden energía cinética debido a los choques) y pueden transmitir la energía de una molécula a otra.
- La temperatura se considera como una medida de la energía cinética media de todas las moléculas. Es decir, que a una temperatura dada, las moléculas de todos los gases tienen el mismo promedio de energía cinética.
- Las fuerzas de atracción entre las moléculas son despreciables
- La presión de un gas es consecuencia de los choques de las moléculas del gas con las paredes del recipiente que las contiene resultando en una fuerza por unidad de superficie (presión).
Todas las masas gaseosas experimentan variaciones de presión (P), volumen (V) y temperatura (T) que se rigen por las leyes de los gases:
LA TEMPERATURA: Según la teoría cinética, la temperatura es una medida de la energía cinética media de los átomos y moléculas que constituyen un sistema. Dado que la energía cinética depende de la velocidad, podemos decir que la temperatura está relacionada con las velocidades medias de las moléculas del gas. Hay varias escalas para medir la temperatura; las más conocidas y utilizadas son las escalas Celsius (ºC), Kelvin (ºK) y Fahrenheit (ºF).
LA PRESION: Según la teoría cinética, la presión de un gas está relacionada con el número de choques por unidad de tiempo de las moléculas del gas contra las paredes del recipiente. Cuando la presión aumenta quiere decir que el número de choques por unidad de tiempo es mayor. 1 atm = 760 mm Hg
EL VOLUMEN: El volumen es el espacio que ocupa un sistema. Recuerda que los gases ocupan todo el volumen disponible del recipiente en el que se encuentran. Decir que el volumen de un recipiente que contiene un gas ha cambiado es equivalente a decir que ha cambiado el volumen del gas. 1 litro = 1000 ml = 1 dm3 = 1000 cm3
CANTIDAD DE GAS: La cantidad de gas está relacionada con el número total de moléculas que se encuentran en un recipiente. La unidad que utilizamos para medir la cantidad de gas es el mol. Un mol es una cantidad igual al llamado número de Avogadro:
1 mol de moléculas= 6,022·1023 moléculas
1 mol de átomos= 6,022·1023 átomos
VolumenL (litros) 1 L = 1000 cm3 1000 L = 1 m3
Temperatura K (Kelvin) T(K) = T(ºC) + 273
Presión atm (atmósferas) 1 atm = 760 mm Hg 1 atm = 101325 Pa
Cantidad de gas mol (moles) 1 mol = Mm g(masa molar en g)
15. ECUACIÓN DE LOS GASES IDEALES O PERFECTOS
15.1. Ley de Boyle y Mariotte
15.1. Ley de Boyle y Mariotte
Si tenemos un gas encerrado en un recipiente de volumen variable y mantenemos la temperatura constante, a medida que reducimos el volumen, la presión aumentará inversamente proporcional y viceversa, es decir:
si el V , entonces la P
, entonces la P es decir: P x V = K1
es decir: P x V = K1
donde K1 es una constante que sólo depende del número de moléculas (cantidad de gas) y de la temperatura.
Supongamos que tenemos un cierto volumen de gas V1 que se encuentra a una presión P1 al comienzo del experimento. Si variamos el volumen de gas hasta un nuevo valor V2, entonces la presión cambiará a P2, y se cumplirá:
ANIMACIONES
15.2. Ley de Charles (P, T son variables; V es constante)
En 1787, Jack Charles (1746-1823) estudió por primera vez la relación entre el volumen y la temperatura de una muestra de gas a presión constante y observó que cuando se aumentaba la temperatura el volumen del gas también aumentaba y que al enfriar el volumen disminuía.
El volumen ocupado por una masa gaseosa es directamente proporcional a su temperatura absoluta, siempre que la presión sea constante.
El volumen es directamente proporcional a la temperatura del gas:
•Si la temperatura aumenta, el volumen del gas aumenta.
•Si la temperatura del gas disminuye, el volumen disminuye.
Cuando aumentamos la temperatura del gas las moléculas se mueven con más rapidez y tardan menos tiempo en alcanzar las paredes del recipiente. Esto quiere decir que el número de choques por unidad de tiempo será mayor. Es decir se producirá un aumento (por un instante) de la presión en el interior del recipiente y aumentará el volumen (el émbolo se desplazará hacia arriba hasta que la presión se iguale con la exterior).
Lo que Charles descubrió es que si la cantidad de gas y la presión permanecen constantes, el cociente entre el volumen y la temperatura siempre tiene el mismo valor. Matemáticamente podemos expresarlo así:
En 1787, Jack Charles (1746-1823) estudió por primera vez la relación entre el volumen y la temperatura de una muestra de gas a presión constante y observó que cuando se aumentaba la temperatura el volumen del gas también aumentaba y que al enfriar el volumen disminuía.
El volumen ocupado por una masa gaseosa es directamente proporcional a su temperatura absoluta, siempre que la presión sea constante.
El volumen es directamente proporcional a la temperatura del gas:
•Si la temperatura aumenta, el volumen del gas aumenta.
•Si la temperatura del gas disminuye, el volumen disminuye.
Cuando aumentamos la temperatura del gas las moléculas se mueven con más rapidez y tardan menos tiempo en alcanzar las paredes del recipiente. Esto quiere decir que el número de choques por unidad de tiempo será mayor. Es decir se producirá un aumento (por un instante) de la presión en el interior del recipiente y aumentará el volumen (el émbolo se desplazará hacia arriba hasta que la presión se iguale con la exterior).
Lo que Charles descubrió es que si la cantidad de gas y la presión permanecen constantes, el cociente entre el volumen y la temperatura siempre tiene el mismo valor. Matemáticamente podemos expresarlo así:
(el cociente entre el volumen y la temperatura es constante)
Supongamos que tenemos un cierto volumen de gas V1 que se encuentra a una temperatura T1 al comienzo del experimento. Si variamos el volumen de gas hasta un nuevo valor V2, entonces la temperatura cambiará a T2, y se cumplirá:
Supongamos que tenemos un cierto volumen de gas V1 que se encuentra a una temperatura T1 al comienzo del experimento. Si variamos el volumen de gas hasta un nuevo valor V2, entonces la temperatura cambiará a T2, y se cumplirá:
Si representamos en una gráfica V = f(T), para cada una de las sustancias sale un recta; y si prolongamos cada una de ellas corta el eje de abcisas en ‑273'15ºC que es el cero absoluto, ya que, teóricamente, a esa temperatura, el volumen de cualquier sustancia sería nulo. Lo mismo ocurre si representamos en una gráfica P = f(T):

Nunca se ha llegado a alcanzar esa temperatura de ‑273'15ºC, por eso, se definió la escala Kelvin de Temperaturas, donde dicho valor se toma como cero absoluto. Es obvio que en esta escala no podrán existir temperaturas negativas ni nula.

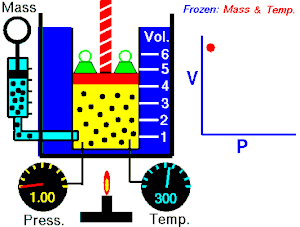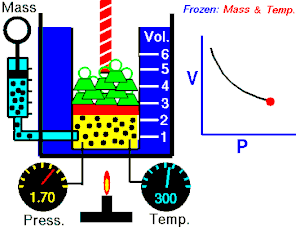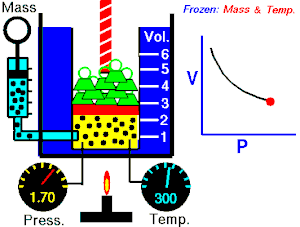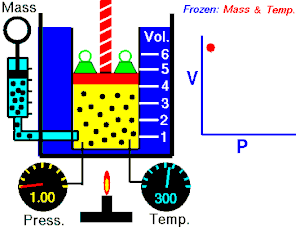


15.3. Ley de Gay-Lussac (V, T son variables; P es constante)
Fue enunciada por Joseph Louis Gay-Lussac (1778-1850) a principios de 1800. Establece la relación entre la temperatura y la presión de un gas cuando el volumen es constante.
La presión ejercida por una masa gaseosa es directamente proporcional a su temperatura absoluta, siempre que el volumen sea constante.
La presión del gas es directamente proporcional a su temperatura:
•Si aumentamos la temperatura, aumentará la presión.
•Si disminuimos la temperatura, disminuirá la presión.
Al aumentar la temperatura las moléculas del gas se mueven más rápidamente y por tanto aumenta el número de choques contra las paredes, es decir aumenta la presión ya que el recipiente es de paredes fijas y su volumen no puede cambiar.
Gay-Lussac descubrió que, en cualquier momento de este proceso, el cociente entre la presión y la temperatura siempre tenía el mismo valor. Matemáticamente podemos expresarlo así:
(el cociente entre la presión y la temperatura es constante)Fue enunciada por Joseph Louis Gay-Lussac (1778-1850) a principios de 1800. Establece la relación entre la temperatura y la presión de un gas cuando el volumen es constante.
La presión ejercida por una masa gaseosa es directamente proporcional a su temperatura absoluta, siempre que el volumen sea constante.
La presión del gas es directamente proporcional a su temperatura:
•Si aumentamos la temperatura, aumentará la presión.
•Si disminuimos la temperatura, disminuirá la presión.
Al aumentar la temperatura las moléculas del gas se mueven más rápidamente y por tanto aumenta el número de choques contra las paredes, es decir aumenta la presión ya que el recipiente es de paredes fijas y su volumen no puede cambiar.
Gay-Lussac descubrió que, en cualquier momento de este proceso, el cociente entre la presión y la temperatura siempre tenía el mismo valor. Matemáticamente podemos expresarlo así:
Supongamos que tenemos un gas que se encuentra a una presión P1 y a una temperatura T1 al comienzo del experimento. Si variamos la temperatura hasta un nuevo valor T2, entonces la presión cambiará a P2, y se cumplirá:
Esta ley, al igual que la de Charles, está expresada en función de la temperatura absoluta. Al igual que en la ley de Charles, las temperaturas han de expresarse en Kelvin.
Si tenemos un gas encerrado en un recipiente y mantenemos la presión constante, si aumentamos la cantidad de gas (moles) el volumen deberá aumentar (para que la presión no varíe), es decir:
si n , entonces, el V
, entonces, el V es decir: V = K3 x n
es decir: V = K3 x n
donde n es el número de moles de gas y K3 es una constante que sólo depende de la presión y de la temperatura.
Supongamos que tenemos una cierta cantidad de gas n1 que ocupa un volumen V1 al comienzo del experimento. Si variamos la cantidad de gas hasta un nuevo valor n2, entonces el volumen cambiará a V2, y se cumplirá:
Hipótesis de Avogadro:
«En un determinado volumen de un gas, sea cual sea el gas contenido, y a una determinada presión y temperatura, siempre existe el mismo número de moléculas».
Ley de Avogadro:
«Un mol de un gas ocupa siempre el mismo volumen que un mol de cualquier otro gas que se encuentre en las mismas condiciones de presión y temperatura. El volumen que ocupa un mol de cualquier gas, en condiciones normales (P= 1 atm, T=273ºK), es de 22,4 L».
Ecuación general del estado gaseoso (P, T, V son variables)
Las tres leyes referidas a un único gas (Boyle, Charles y Gay-Lussac) se pueden resumir en una única ecuación matemática:
Fíjate en que si mantienes constante la temperatura T, la ecuación general se reduce a PV=cte, ya que al ser T1 = T2 puedes simplificar la igualdad. Es decir, se obtiene la ley de Boyle (PV=k). Evidentemente, la constante de esta ley de Boyle es distinta de la anterior.
De forma similar, manteniendo constante la presión o el volumen, obtendrás las leyes de Charles (V/T=k´´) y deGay-Lussac (P/T=k´´´).
Es importante que te fijes en que las constantes de las leyes dependen de la cantidad de gas que hay en el recipiente y su valor es diferente en cada ley.
La ley general de los gases o ley combinada dice que una masa de un gas ocupa un volumen que está determinado por la presión y la temperatura de dicho gas.
La ley de los gases ideales es la ecuación de estado del gas ideal, un gas hipotético formado por partículas puntuales, sin atracción ni repulsión entre ellas y cuyos choques con perfectamente elásticos Se observan una serie de relaciones entre la temperatura, la presión y el volumen que dan lugar a la ley de los gases ideales.
La ecuación que describe normalmente la relación entre la presión el volumen, la temperatura y la cantidad (en moles) de un gas ideal es:

Donde:
P= Presión (atm)
V= Volumen (l)
n= Moles de Gas
R= Constante universal de los gases ideales
T= Temperatura absoluta (ºK)
| R = 0,082 (atm.litro/mol.K) |
| R = 1,98 (calorías/mol.K) |
| R = 8,31 ( julios/mol.K ) |
Las condiciones normales de operación se definen como:
| P = 1 atm |
| T = 0 ºC = 273 K |
sustituyendo en la ecuación de los gases ideales podemos determinar el volumen que ocupará 1 mol de un gas en condiciones normales:
P . V = n . R . T
1 . V = 1 . 0'082 . 273
V = 22'4 litros
un mol de cualquier gas en c.n. (condiciones normales) ocupa 22'4 litros
15.5. Disoluciones gaseosas. Ley de Dalton de las presiones parciales
Cuando tenemos una mezcla de gases ideales contenidos en un volumen V, se puede escribir (aplicando la ecuación de los gases perfectos, que:
Cuando tenemos una mezcla de gases ideales contenidos en un volumen V, se puede escribir (aplicando la ecuación de los gases perfectos, que:

de forma general:

Por otra parte:

 si dividimos ordenadamente
si dividimos ordenadamente 

y despejando la presión parcial del gas A:


por lo tanto, la ley de Dalton de las presiones parciales viene determinada por la ecuación:
| PA = PT . xA |
| PB = PT . xB |
y de forma general:

Es fácil comprobar que:
| xA + xB = 1 |
| PA + PB = PT |
y de forma general:

16. CUESTIONES
17. PROBLEMAS
18. PRÁCTICAS
19. OTROS CONTENIDOS
La reacción química
La naturaleza de la materia
La naturaleza de la materia 2
La naturaleza de la materia 3
Conceptos básicos de química
Leyes de los gases perfectos
Disoluciones
Materia, elementos y compuestos
La naturaleza de la materia
La naturaleza de la materia 2
La naturaleza de la materia 3
Conceptos básicos de química
Leyes de los gases perfectos
Disoluciones
Materia, elementos y compuestos
20. VÍDEOS
Balanceo de ecuaciones redox
Factor que afecta la velocidad : la temperatura
Factor que afecta la velocidad : la concentración Vídeo 1
Vídeo 2
Vídeo 3
Vídeo 4
Oxidación de una manzanaCombustión del metano
Combustión del propanoReaccione químicas
Factor que afecta la velocidad : la temperatura
Factor que afecta la velocidad : la concentración Vídeo 1
Vídeo 2
Vídeo 3
Vídeo 4
Oxidación de una manzanaCombustión del metano
Combustión del propanoReaccione químicas


































































































No hay comentarios:
Publicar un comentario