|
9. Estados de la materia
1. Estado sólido
2. Estado líquido
3. Estado gaseoso
4. Cambios de estado
10. Teoría cinética 11. Ley de Avogadro 12. Ley de Boyle 13. Ley de Charles 14. Ley de Gay-Lussac 15. Ley de los gases ideales 16. Ley de las presiones parciales 17. Ley de Henry 18. Problemas 19. Prácticas 20. Cuestiones
21. Vídeos
|
1. ESQUEMAS
2. PRESENTACIONES


3. CONTENIDOS ANIMADOS







4. LA TEMPERATURA
Por medio del tacto notamos la temperatura al tocar un cuerpo ya que unas terminaciones nerviosas situadas en la piel se encargan de ello.
Vamos estudiar el comportamiento de un gas para tratar de asociar esta sensación a una magnitud (algo que podemos medir) y para comprender qué cualidades de la materia manifiesta.
Toda la materia está formada por partículas en continua agitación:. incluso los sólidos, que a simple vista parecen estar en reposo, la tienen.
En los sólidos las vibraciones son pequeñas. Si la energía de agitación es muy grande, se pueden llegar a romper los enlaces entre las moléculas y entre los átomos.
Las partículas se desenlazan y vibran libres, rotan, chocan entre si y contra las paredes del recipiente. Este estado de la materia se llama gaseoso. El gas trata de ocupar todo el volumen del recipiente que lo contiene: trata de expandirse.
No todas las partículas se mueven en la misma dirección y con la misma velocidad. A cada estado concreto se le puede asignar una velocidad media.
En un gas la temperatura es una magnitud (algo que podemos medir) que se relaciona con la medida de la velocidad media con que se mueven las partículas (por lo tanto con su energía cinética o nivel de agitación).
La temperatura no depende del número de partículas que se mueven sino de su velocidad media: a mayor temperatura mayor velocidad media. No depende por tanto de la masa total del cuerpo: si dividimos un cuerpo con una temperatura "T" en dos partes desiguales las dos tienen la misma temperatura.
La temperatura es una magnitud que refleja el nivel térmico de un cuerpo (su capacidad para ceder energía calorífica) y el calor es la energía que pierde o gana en ciertos procesos (es un flujo de energía entre dos cuerpos que están a diferentes temperaturas).
Nivel térmico es el nivel de agitación. Comparando los niveles térmicos sabemos hacia donde fluye el calor.
La temperatura refleja el nivel térmico de un cuerpo e indica el sentido en que fluye el calor.
¿Cómo se mide la temperatura?
Nuestro tacto detecta la temperatura, pero carece de la capacidad de medirla con rigor.

Introduce una mano en un recipiente frío y la otra en uno caliente, y luego las dos manos juntas en otro recipiente con agua templada.
La primera mano la encontrará caliente y la otra fría.
Del cuerpo que está a mayor temperatura decimos que "está más caliente" y a veces, erróneamente, se dice "que tiene más calor". Los cuerpos no tienen calor, tienen energía interna y tienen temperatura. Reservamos el término "calor" para la energía que se transfiere de un cuerpo a otro. Esta energía es fácil de medir, pero la energía total que tiene el cuerpo no.
Si un cuerpo recibe energía calorífica aumenta la agitación de las partículas que lo forman (átomos, moléculas o iones) y se pueden producir también cambios en la materia: dilatación, cambios de color (piensa en una barra de metal al calentarla), variación de su resistencia a la conducción, etc. Estos cambios se pueden utilizar para hacer una escala de temperatura.
Al poner en contacto dos sustancias la agitación de las partículas de una se transmite, mediante choques, a las partículas de la otra hasta que se igualan sus velocidades. Las partículas de la sustancia más caliente son más rápidas y poseen más energía. En cada impacto ceden parte de la energía a las partículas más lentas con las que entran en contacto. Las partículas de la sustancia que está a mayor T se frenan un poco, pero al mismo tiempo hacen que la más lentas aceleren.
Finalmente las partículas de las dos sustancias alcanzan la misma velocidad media y por lo tanto la misma temperatura: se alcanza el "equilibrio térmico".
Para diseñar un instrumento que mida la temperatura debemos escoger una cualidad de la materia que sea fácilmente observable, que varíe de manera importante con la agitación de sus partículas, que sea fácil de medir y que nos permita relacionar su variación con la agitación que tiene el cuerpo.
La cualidad elegida en los termómetros de mercurio es la dilatación, pero existen otros tipos de termómetros basados en otras cualidades.
Se utiliza el mercurio para construir termómetros porque es un metal que es líquido entre -20 ºC y 100ºC y porque se dilata mucho. Encerramos el metal dentro de un tubo fino (capilar) para que al dilatarse un poco avance mucho por el tubo (cuanto más fino sea el tubo más centímetros avanza). Midiendo longitudes de la columna podemos establecer una relación entre la dilatación y el nivel de agitación de la sustancia a medir.




¡Medimos la temperatura midiendo una longitud!
Se pueden tomar como base para medir las temperaturas otras propiedades que cambien con ella como el color, la resistencia eléctrica, etc. Aparatos basados en las anteriores propiedades son el pirómetro óptico, el termopar....
Esto posibilita el medir en distintos rangos de temperaturas. Piensa en lo que pasaría si midieras la temperatura de un alto horno con un termómetro de mercurio.
4.1. Calibrado del termómetro. Escala Celsius de temperatura
Celsius, eligió como cero de temperatura para su escala la temperatura del hielo en contacto con agua. Las temperaturas inferiores, por lo tanto, serán negativas.
Para marcar ese punto en el termómetro, lo introducimos en una mezcla de agua y hielo y esperamos hasta que se estabilice la posición del mercurio de la columna. Marcamos ese punto en el vidrio (es el extremo de la columna de mercurio en ese momento) como punto 0.




Calentamos agua en un Erlenmeyer cerrado con un tapón bihoradado. Por un agujero del tapón sale un tubo y por él vapor, por el otro introducimos el termómetro. Se inserta hasta que el bulbo quede en un punto próximo a la superficie del agua.
La columna de mercurio sube pero cuando el agua empieza a hervir se para y no sube más. Marcamos el vidrio en ese punto como punto 100. Si la presión no es 1 atm. la temperatura de ebullición no será 100 ºC.
Dividimos la longitud del vidrio entre 0 y 100 en 100 partes iguales. A cada división le corresponde 1 grado centígrado.
Con el termómetro de mercurio medimos la temperatura del aire. Este es el dato climatológico más conocido.
Vamos estudiar el comportamiento de un gas para tratar de asociar esta sensación a una magnitud (algo que podemos medir) y para comprender qué cualidades de la materia manifiesta.
Toda la materia está formada por partículas en continua agitación:. incluso los sólidos, que a simple vista parecen estar en reposo, la tienen.
En los sólidos las vibraciones son pequeñas. Si la energía de agitación es muy grande, se pueden llegar a romper los enlaces entre las moléculas y entre los átomos.
Las partículas se desenlazan y vibran libres, rotan, chocan entre si y contra las paredes del recipiente. Este estado de la materia se llama gaseoso. El gas trata de ocupar todo el volumen del recipiente que lo contiene: trata de expandirse.
No todas las partículas se mueven en la misma dirección y con la misma velocidad. A cada estado concreto se le puede asignar una velocidad media.
En un gas la temperatura es una magnitud (algo que podemos medir) que se relaciona con la medida de la velocidad media con que se mueven las partículas (por lo tanto con su energía cinética o nivel de agitación).
La temperatura no depende del número de partículas que se mueven sino de su velocidad media: a mayor temperatura mayor velocidad media. No depende por tanto de la masa total del cuerpo: si dividimos un cuerpo con una temperatura "T" en dos partes desiguales las dos tienen la misma temperatura.
La temperatura es una magnitud que refleja el nivel térmico de un cuerpo (su capacidad para ceder energía calorífica) y el calor es la energía que pierde o gana en ciertos procesos (es un flujo de energía entre dos cuerpos que están a diferentes temperaturas).
Nivel térmico es el nivel de agitación. Comparando los niveles térmicos sabemos hacia donde fluye el calor.
La temperatura refleja el nivel térmico de un cuerpo e indica el sentido en que fluye el calor.
¿Cómo se mide la temperatura?
Nuestro tacto detecta la temperatura, pero carece de la capacidad de medirla con rigor.
Introduce una mano en un recipiente frío y la otra en uno caliente, y luego las dos manos juntas en otro recipiente con agua templada.
La primera mano la encontrará caliente y la otra fría.
Del cuerpo que está a mayor temperatura decimos que "está más caliente" y a veces, erróneamente, se dice "que tiene más calor". Los cuerpos no tienen calor, tienen energía interna y tienen temperatura. Reservamos el término "calor" para la energía que se transfiere de un cuerpo a otro. Esta energía es fácil de medir, pero la energía total que tiene el cuerpo no.
Si un cuerpo recibe energía calorífica aumenta la agitación de las partículas que lo forman (átomos, moléculas o iones) y se pueden producir también cambios en la materia: dilatación, cambios de color (piensa en una barra de metal al calentarla), variación de su resistencia a la conducción, etc. Estos cambios se pueden utilizar para hacer una escala de temperatura.
Al poner en contacto dos sustancias la agitación de las partículas de una se transmite, mediante choques, a las partículas de la otra hasta que se igualan sus velocidades. Las partículas de la sustancia más caliente son más rápidas y poseen más energía. En cada impacto ceden parte de la energía a las partículas más lentas con las que entran en contacto. Las partículas de la sustancia que está a mayor T se frenan un poco, pero al mismo tiempo hacen que la más lentas aceleren.
Finalmente las partículas de las dos sustancias alcanzan la misma velocidad media y por lo tanto la misma temperatura: se alcanza el "equilibrio térmico".
Para diseñar un instrumento que mida la temperatura debemos escoger una cualidad de la materia que sea fácilmente observable, que varíe de manera importante con la agitación de sus partículas, que sea fácil de medir y que nos permita relacionar su variación con la agitación que tiene el cuerpo.
La cualidad elegida en los termómetros de mercurio es la dilatación, pero existen otros tipos de termómetros basados en otras cualidades.
Se utiliza el mercurio para construir termómetros porque es un metal que es líquido entre -20 ºC y 100ºC y porque se dilata mucho. Encerramos el metal dentro de un tubo fino (capilar) para que al dilatarse un poco avance mucho por el tubo (cuanto más fino sea el tubo más centímetros avanza). Midiendo longitudes de la columna podemos establecer una relación entre la dilatación y el nivel de agitación de la sustancia a medir.
¡Medimos la temperatura midiendo una longitud!
Se pueden tomar como base para medir las temperaturas otras propiedades que cambien con ella como el color, la resistencia eléctrica, etc. Aparatos basados en las anteriores propiedades son el pirómetro óptico, el termopar....
Esto posibilita el medir en distintos rangos de temperaturas. Piensa en lo que pasaría si midieras la temperatura de un alto horno con un termómetro de mercurio.
4.1. Calibrado del termómetro. Escala Celsius de temperatura
Celsius, eligió como cero de temperatura para su escala la temperatura del hielo en contacto con agua. Las temperaturas inferiores, por lo tanto, serán negativas.
Para marcar ese punto en el termómetro, lo introducimos en una mezcla de agua y hielo y esperamos hasta que se estabilice la posición del mercurio de la columna. Marcamos ese punto en el vidrio (es el extremo de la columna de mercurio en ese momento) como punto 0.
Calentamos agua en un Erlenmeyer cerrado con un tapón bihoradado. Por un agujero del tapón sale un tubo y por él vapor, por el otro introducimos el termómetro. Se inserta hasta que el bulbo quede en un punto próximo a la superficie del agua.
La columna de mercurio sube pero cuando el agua empieza a hervir se para y no sube más. Marcamos el vidrio en ese punto como punto 100. Si la presión no es 1 atm. la temperatura de ebullición no será 100 ºC.
Dividimos la longitud del vidrio entre 0 y 100 en 100 partes iguales. A cada división le corresponde 1 grado centígrado.
Con el termómetro de mercurio medimos la temperatura del aire. Este es el dato climatológico más conocido.
4.2. Escalas termométricas
Para medir la magnitud temperatura se utilizan diversas escalas:
Escala Celsius o centígrada
Creada por Anders Celsius, es la escala más utilizada internacionalmente. En esta escala se elige la temperatura de congelación del agua para ubicar el 0 y la temperatura de ebullición del agua para colocar el 100 . Un grado centígrado (ºC) es pues la centésima parte de esa diferencia de temperaturas.
Escala Kelvin o absoluta .
Es la escala de temperatura absoluta, creada por William Thomson. En esta escala se ubica el 0 en la temperatura más baja (-273 ºC) que puede existir en el universo; temperatura a la cual la materia no tendría energía interna, el movimiento de las partículas que forman la materia quedaría detenido. El grado Kelvin (K) equivale al centígrado y para pasar de una escala a otra se utiliza:
T ( en K) = t (enºC) + 273 t (en ºC) = T (en K) - 273
|
Escala Farenheit
El grado Farenheit no es igual que el Kelvin o Celsius, ya que Farenheit coloca el 0 a la temperatura de una mezcla de agua, hielo y cloruro amónico (-32ºC) , y el 96 en la temperatura del cuerpo humano (37 ºC) , por ello la conversión entre una escala y otra viene dada por:
| Escalas |
Celsius
|
Kevin
|
Fahrenheit
| |
| Unidad |
ºC
|
K
|
ºF
| |
| Temperaturas de referencia | Punto de fusión del agua |
0
|
273
|
32
|
| Punto de vaporización del agua |
100
|
373
|
212
| |
Equivalencias
|
K=273+ºC
|
ºF=1,8•ºC+32
| ||
En este esquema comparativo puedes ver las escalas más importantes:
4.3. Conversión de valores de temperaturas
La escala Celsius y la escala Kelvin tiene una transformación muy sencilla:
grados K = 273.15 + grados C
En la transformación de grados centígrados a grados Fahrenheit debes tener en cuenta que cada grado centígrado vale 1,8 ºF ( 0 - 100 en la escala centígrada equivale a 32 - 210 en la escala Fahrenheit). Por lo tanto debes multiplicar los grados centígrados por 1,8 que equivale a 9/5 . Como el cero Celsisus corresponde al 32 Fahrenheit debes sumar 32:
grados F = (9/5) * grados C + 32
Para la transformación inversa se despeja y queda:
grados C = ( 5/9) * ( grados F - 32)
ANIMACIONES



5. CALOR
Durante muchos años se creyó que el calor era un componente que impregnaba la materia y que los cuerpo absorbían o desprendían según los casos.
Rumford, taladrando tubos de metal para construir cañones, se dio cuenta de que cuanto más roma estaba la broca más calor se desprendía. ¡El calor se generaba al rozar la broca con el metal! ¡La energía cinética de la broca se transformaba en calor!
El calor es por lo tanto una forma de energía. Es la "energía calorífica". Un inglés llamado J.P. Joule halló su equivalencia con las unidades del trabajo.
El Universo está hecho de materia y energía. La materia está compuesta de átomos y moléculas (que son grupos de átomos) y la energía hace que los átomos y las moléculas estén en constante movimiento: rotando alrededor de si mismas, vibrando o chocando unas con otras. Cuando la materia desaparece (a veces esto ocurre espontáneamente en las sustancias radiactivas) se transforma en energía (E=mc2)
El movimiento de los átomos y moléculas está relacionado con el calor o energía térmica. Al calentar una sustancia aumenta la velocidad de las partículas que la forman.
La cantidad total y absoluta de energía que tiene un cuerpo, que es la que podría teóricamente ceder, es muy difícil de precisar.
Nos referimos al calor como a esa energía que intercambian los cuerpos (energía de tránsito) y que podemos medir fácilmente.
El calor es una energía que fluye de los cuerpos que se encuentran a mayor temperatura a los de menor temperatura. Para que fluya se requiere una diferencia de temperatura. El cuerpo que recibe calor aumenta su temperatura, el que cede calor disminuye su temperatura. Resulta evidente que los dos conceptos, calor y temperatura, están relacionados.
El calor es una energía de tránsito, sólo tiene sentido hablar de variación de calor mientras la energía fluye de un cuerpo a otro.
Es una energía degradada ya que es imposible recuperar toda la energía mecánica que se invirtió en producirlo. Se recupera energía mecánica haciéndolo fluir en las máquinas térmicas del foco caliente al frío y retirando parte de esa energía en forma de energía mecánica (movimiento) pero una parte importante del calor debemos arrojarla al entorno en el foco frío.
Los rendimientos de la máquinas se calculan por la relación de temperaturas entre las que funcionan y es imposible un rendimiento del 100%
R = (T1-T2) / T1
La energía puede presentarse de muy diferentes formas y puede cambiar de una forma a otra.
Pero existen muchas transformaciones de energía.....
- Ya vimos la experiencia en la que por rozamiento la broca transformaba energía cinética en energía calorífica.
- La energía electromagnética (luz del Sol) calienta la Tierra. Esta es la primera fuente de toda la energía que llega a la Tierra y que luego se transforma en otros tipos de energía.
- Los cuerpos emiten energía calorífica en forma de radiación en el infrarrojo.
- Las reacciones química de combustión desprenden calor (exotérmicas), otras lo absorben (endotérmicas).
- La electricidad circulando por una resistencia la calienta.
- Un balón al chocar contra el suelo transforma su energía mecánica en calor al deformarse.
- Nuestros cuerpos transforman la energía química de los alimentos en calor: para vivir necesitamos unas 2.100.000 calorías al día.
- Las reacciones nucleares generan calor al desaparecer la masa.
- Al producir un sonido hacemos vibrar las partículas de aire y esta energía se transmite en el aire: las ondas transportan energía.
Esta cualidad del agua es la responsable del clima benigno (poco oscilante entre el día y la noche) en las proximidades del mar para una misma latitud terrestre.
La capacidad del agua de "encajar" los impactos de calor "sin casi inmutarse" incrementando poco su temperatura se representa mediante una magnitud llamada "calor específico" (Ce) : calor que necesita 1 g de sustancia para aumentar 1 grado su temperatura.
En consecuencia, el calor específico del agua es 1 cal /g. grado.
Se llama caloría " la cantidad de calor necesaria para que 1g de agua aumente 1º su temperatura" ( más exactamente para pasar de 14,5 º a 15,5º)
Una vez demostrado que el calor es una forma de energía se halló su equivalencia con otras unidades que surgieron del estudio de la energía mecánica. Hoy se utiliza siempre el S.I. y usamos como unidad de trabajo y de energía el julio (1 caloría = 4,18 Julios ).
En el Sistema Internacional el Calor eespecífico (agua) = 4180 J / kg ºK.
Cada sustancia tiene un calor específico característico, casi siempre mucho menor que el del agua.
Tabla de calores específicos .
| |
Sustancias
|
Calor específico (J/kg•K)
|
Agua
|
4180
|
Hielo
|
2100
|
Aluminio
|
910
|
Hierro
|
447
|
Cobre
|
386
|
Pero la cantidad de calor que puede acumular o perder una masa de agua depende, además de su calor específico, de la masa de la sustancia. El producto de la masa por el calor específico se llama "capacidad calorífica".
Cuanta más capacidad calorífica tenga un cuerpo menos incremente su temperatura para un mismo aporte de calor. Es como la capacidad que tiene la sustancia para "encajar" el calor.
El calor necesario para un mismo incremento de temperatura de una cierta sustancia depende de su masa: cuanta más masa, más calor se requiere.
Uniendo todos los factores anteriores obtenemos la fórmula que nos da el calor cedido o absorbido por un cuerpo cuando varía su temperatura:
Q = m cuerpo · Ce (cuerpo) . ( Tf - Ti)
A veces la sustancia recibe energía (calor) y no incrementa su temperatura. Es lo que ocurre en los cambios de estado. Un caso concreto lo tenemos en la fusión del hielo. Si suministramos calor a una mezcla formada por hielo fundido y hielo sin fundir el calor se emplea en fundir más hielo y la temperatura del agua no se incrementa.
ANIMACIONES









5.2. Formas de transmisión del calor
5.2.1 Conducción
Si se calienta el extremo de una barra metálica al poco tiempo el calor llega al extremo más alejado de la fuente de calor. Este proceso es un ejemplo de la conducción de calor.
En la conducción de calor las partículas más cercanas a la fuente de calor se agitan con más energía que las que están más alejadas. Esta energía se comunica de unas partículas a las más cercanas (por contacto) hasta que la energía se reparte por todo el sólido.
En la conducción el calor se trasmite por interacción entre las partículas que forman las sustancias sin que exista un desplazamiento neto de esas partículas.
Esta forma de transmisión de calor es típica de los sólidos , pero no en todos esta conducción se realiza a la misma velocidad los buenos conductores de calor permite el paso rápido del calor (los metales por ejemplo son buenos conductores térmicos).los malos conductores o aislantes del calor dificultan la transmisión del calor a través de ellos (por ejemplo la madera es un buen aislante térmico o mal conductor del calor).
5.2.2. Convección
Cuando se mezcla leche fría con café muy caliente, observamos que ambos líquidos se mezclan hasta quedar a una temperatura tibia. Se ha producido una transferencia de calor desde el café a la leche. Esta transferencia es un ejemplo de transferencia por convección.
En la convección se trasmite el calor por desplazamiento de las partículas que forman los cuerpos.
Esta forma de transferencia del calor es típica de líquidos y gases. Ejemplos son las corrientes de convección que se establecen en el aire atmosférico.
5.2.3. Radiación
Cuando nos acercamos a un cuerpo muy caliente, se nota que llega calor desde él. Lo mismo ocurre con el calor del Sol, que se recibe desde millones de kilómetros, sin que entre él y la Tierra haya ningún medio material que transporte la energía.
En la transmisión por radiación el calor se propaga sin necesitar la ayuda de materia. La energía calorífica se trasmite por ondas electromagnéticas.
Las radiaciones electromagnéticas son ondas que pueden viajar a través de la materia pero también a través del vacío.
Si el cuerpo está a la misma temperatura que su entorno quiere decir que emite la misma cantidad de radiación que absorbe.
Si el cuerpo está a mayor temperatura que el entorno, entonces emite más radiación que la que absorbe.
Si el cuerpo está a menos temperatura entonces absorbe más radiación que la que emite.
La cantidad de energía por radiación que absorbe o emite un cuerpo depende de la temperatura y la superficie.
ANIMACIONES

5.3. Energía interna
La energía interna se define como la energía asociada con el movimiento aleatorio y desordenado de las moléculas. Está en una escala separada de la energía macroscópica ordenada, que se asocia con los objetos en movimiento. Se refiere a la energía microscópica invisible de la escala atómica y molecular. Por ejemplo, un vaso de agua a temperatura ambiente sobre una mesa, no tiene energía aparente, ya sea potencial o cinética. Pero en escala microscópica, es un hervidero de moléculas de alta velocidad que viajan a cientos de metros por segundo.
La u es el símbolo común mas usado para representar la energía interna.
Las cantidades relacionadas con la energía, que son particularmente útiles en la termodinámica química son la entalpía, la energia libre de Helmholtz, y la energía libre de Gibbs.
6. PRESIÓN
En Física, llamamos presión a la relación que existe entre una fuerza y la superficie sobre la que se aplica:
P = F / S
Dado que en el Sistema Internacional la unidad de fuerza es el newton (N) y la de superficie es el metro cuadrado (m2), la unidad resultante para la presión es el newton por metro cuadrado (N/m2) que recibe el nombre de pascal (Pa)
1 Pa = 1 N / m2
Otra unidad muy utilizada para medir la presión, aunque no pertenece al Sistema Internacional, es el milímetro de mercurio (mm Hg) que representa una presión equivalente al peso de una columna de mercurio de 1 mm de altura. Esta unidad está relacionada con la experiencia de Torricelli que encontró, utilizando un barómetro de mercurio, que al nivel del mar la presión atmosférica era equivalente a la ejercida por una columna de mercurio de 760 mm de altura.
En este caso la fuerza se correspondería con el peso (m·g) de la columna de mercurio por lo que
P = m · g / S
Como la masa puede expresarse como el producto de la densidad por el volumen (m = d · V), si sustituimos será:
P = d · V · g / S
y dado que el volumen es el producto de la superficie de la base por la altura (V = S · h), tenemos
P = d · S · h · g / S
que podemos simplificar quedando:
P = d · g · h
que nos permite calcular la presión en función de la densidad, la intensidad del campo gravitatorio y la altura de la columna.
Sustituyendo los correspondientes valores en la ecuación anterior tenemos que:
P = d · g · h = 13600 kg/m3 · 9,8 N/kg · 0,76 m ˜ 101300 N/m2 = 101300 Pa
En este trabajo usaremos la atmósfera (atm) y el milímetro de mercurio (mmHg):
1 atm = 760 mm Hg
Según la teoría cinética, la presión de un gas está relacionada con el número de choques por unidad de tiempo de las moléculas del gas contra las paredes del recipiente. Cuando la presión aumenta quiere decir que el número de choques por unidad de tiempo es mayor.
El simulador de arriba cuenta el número de choques contra una de las paredes del cubo y el tiempo transcurrido. La cantidad de choques por segundo, o frecuencia, se va calculando dividiendo la cantidad de choques entre el tiempo transcurrido.
En cada choque se aplicará una fuerza sobre la pared que dependerá de la masa y de la velocidad de la molécula y la relación entre esta fuerza y la superficie de la pared nos daría la presión. La presión está relacionada con la frecuencia de estos choques ya que de ella dependerá la cantidad total de fuerza que se aplique sobre las paredes en cada unidad de tiempo.
Si te fijas, la frecuencia de los choques no es siempre igual porque tenemos sólo unas pocas moléculas. Si en lugar de 6 hubiera varios miles de millones encontraríamos que la frecuencia es un valor constante, pero no podemos hacerlo porque la informática también tiene sus limitaciones.
Debido a que en un gas el número de moléculas es del orden de 1023, la cantidad de movimiento transferida a la pared es constante y uniforme en todos los puntos en situación de equilibrio térmico. En otras palabras, la presión en un gas es la misma en todos los puntos del recipiente cuando existe equilibrio térmico.
ANIMACIONES




| La presión según la TCM Concepto de presión según la teo |
7. VOLUMEN
El volumen es el espacio que ocupa un sistema. Recuerda que los gases ocupan todo el volumen disponible del recipiente en el que se encuentran. Decir que el volumen de un recipiente que contiene un gas ha cambiado es equivalente a decir que ha cambiado el volumen del gas.
En el laboratorio se utilizan frecuentemente jeringuillas como recipientes de volumen variable cuando se quiere experimentar con gases.
Hay muchas unidades para medir el volumen. En este trabajo usaremos el litro (L) y el mililitro (mL). Su equivalencia es:
1L = 1000 mL
Como 1 L es equivalente a 1 dm3, es decir a 1000 cm3, tenemos que el mL y el cm3 son unidades equivalentes.
ANIMACIONES

| Ley de Charles Laboratorio virtual para estudiar la ley de Cha |
8. HIPÓTESIS DE AVOGADRO
Los gases ideales cumplen la hipótesis de Avogadro que establece que "una cantidad de cualquier tipo de gas, en un mismo volumen, a la misma temperatura y la misma presión, contiene el mismo número de moléculas, independientemente del tipo de gas que sea".
En condiciones normales (0ºC y 1 atm), 1 mol de gas ideal (que contiene NA moléculas), ocupa 22,4 litros, independientemente del tipo de gas que haya dentro del recipiente.
Los gases ideales cumplen la hipótesis de Avogadro que establece que "una cantidad de cualquier tipo de gas, en un mismo volumen, a la misma temperatura y la misma presión, contiene el mismo número de moléculas, independientemente del tipo de gas que sea".
En condiciones normales (0ºC y 1 atm), 1 mol de gas ideal (que contiene NA moléculas), ocupa 22,4 litros, independientemente del tipo de gas que haya dentro del recipiente.
Un mol es una cantidad igual al llamado número de Avogadro:
1 mol de moléculas = 6,022 · 1023 moléculas
1 mol de átomos = 6,022 · 1023 átomos ¡¡¡ 602.200.000.000.000.000.000.000 !!!
La masa molar de una sustancia pura es la masa que corresponde a 1 mol de dicha sustancia:
masa molar = masa en gramos / cantidad de moles
Actividad animada:
H2
|
CH4
|
Cl2
|
I2
|
|
moles
|
||||
masa matraz vacío
|
||||
masa matraz + gas
|
||||
masa sólo gas
|
||||
masa molar
|
2.- ¿Cuántas
moléculas hay en cada matraz?
número de
moléculas
|
|
matraz vacío
|
|
matraz con 15 mol de H2
|
|
matraz con 8.3 mol de CH4
|
|
matraz con 7.5 mol de Cl2
|
|
matraz con 3 mol de I2
|
3.- ¿Cuántos
átomos hay en cada matraz?
número de átomos
|
|
matraz vacío
|
|
matraz con 15 mol de H2
|
|
matraz con 8.3 mol de CH4
|
|
matraz con 7.5 mol de Cl2
|
|
matraz con 3 mol de I2
|
4.- ¿Cuál es el
matraz que contiene más hidrógeno?
átomos de H
|
|
matraz con 15 mol de H2
|
|
matraz con 8.3 mol de CH4
|
5.- Redacta un
pequeño informe explicando la estrategia que has seguido para realizar las
pesadas. (¡aprovecha la otra cara del folio!)
Molécula es una agrupación de átomos del mismo o distintos elementos que se comporta de forma independiente en estado gaseoso. Los átomos de una molécula están unidos por enlaces entre ellos.
Un mol de una sustancia es la cantidad de ésta que contiene 6,022 · 1023 unidades elementales, sean átomos, moléculas o cualquier otro tipo de agrupación. La masa de un mol de cualquier sustancia equivale a su masa, molecular o atómica, expresada en gramos.
Una u (uma) es la masa equivalente a la masa de la doceava parte de un átomo de carbono 12. Equivale a 1,66 · 10–24 g.
ANIMACIONES
Ejercicios ecuación de los gases Entrena haciendo ejercicios sobre la ley de los ga |
9. ESTADOS DE LA MATERIA
La materia se presenta en tres estados o formas de agregación: sólido, líquido y gaseoso.
Dadas las condiciones existentes en la superficie terrestre, sólo algunas sustancias pueden hallarse de modo natural en los tres estados, tal es el caso del agua.
La mayoría de sustancias se presentan en un estado concreto. Así, los metales o las sustancias que constituyen los minerales se encuentran en estado sólido y el oxígeno o el CO2 en estado gaseoso:
- Los sólidos: Tienen forma y volumen constantes. Se caracterizan por la rigidez y regularidad de sus estructuras.
- Los líquidos: No tienen forma fija pero sí volumen. La variabilidad de forma y el presentar unas propiedades muy específicas son características de los líquidos.
- Los gases: No tienen forma ni volumen fijos. En ellos es muy característica la gran variación de volumen que experimentan al cambiar las condiciones de temperatura y presión.
Los sólidos se caracterizan por tener forma y volumen constantes. Esto se debe a que las partículas que los forman están unidas por unas fuerzas de atracción grandes de modo que ocupan posiciones casi fijas.
En el estado sólido las partículas solamente pueden moverse vibrando u oscilando alrededor de posiciones fijas, pero no pueden moverse trasladándose libremente a lo largo del sólido.
Las partículas en el estado sólido propiamente dicho, se disponen de forma ordenada, con una regularidad espacial geométrica, que da lugar a diversas estructuras cristalinas.
Al aumentar la temperatura aumenta la vibración de las partículas:
9.2. Estado líquido
Los líquidos, al igual que los sólidos, tienen volumen constante. En los líquidos las partículas están unidas por unas fuerzas de atracción menores que en los sólidos, por esta razón las partículas de un líquido pueden trasladarse con libertad. El número de partículas por unidad de volumen es muy alto, por ello son muy frecuentes las colisiones y fricciones entre ellas.Así se explica que los líquidos no tengan forma fija y adopten la forma del recipiente que los contiene. También se explican propiedades como la fluidez o la viscosidad.
En los líquidos el movimiento es desordenado, pero existen asociaciones de varias partículas que, como si fueran una, se mueven al unísono. Al aumentar la temperatura aumenta la movilidad de las partículas (su energía).
9.3. Estado gaseoso
Los gases, igual que los líquidos, no tienen forma fija pero, a diferencia de éstos, su volumen tampoco es fijo. También son fluidos, como los líquidos.
En los gases, las fuerzas que mantienen unidas las partículas son muy pequeñas. En un gas el número de partículas por unidad de volumen es también muy pequeño.
Las partículas se mueven de forma desordenada, con choques entre ellas y con las paredes del recipiente que los contiene. Esto explica las propiedades de expansibilidad y compresibilidad que presentan los gases: sus partículas se mueven libremente, de modo que ocupan todo el espacio disponible. La compresibilidad tiene un límite, si se reduce mucho el volumen en que se encuentra confinado un gas éste pasará a estado líquido.
Al aumentar la temperatura las partículas se mueven más deprisa y chocan con más energía contra las paredes del recipiente, por lo que aumenta la presión
Los gases, igual que los líquidos, no tienen forma fija pero, a diferencia de éstos, su volumen tampoco es fijo. También son fluidos, como los líquidos.
En los gases, las fuerzas que mantienen unidas las partículas son muy pequeñas. En un gas el número de partículas por unidad de volumen es también muy pequeño.
Las partículas se mueven de forma desordenada, con choques entre ellas y con las paredes del recipiente que los contiene. Esto explica las propiedades de expansibilidad y compresibilidad que presentan los gases: sus partículas se mueven libremente, de modo que ocupan todo el espacio disponible. La compresibilidad tiene un límite, si se reduce mucho el volumen en que se encuentra confinado un gas éste pasará a estado líquido.
Al aumentar la temperatura las partículas se mueven más deprisa y chocan con más energía contra las paredes del recipiente, por lo que aumenta la presión
ANIMACIONES





Fusión | sustancia pura. Punto de fusión del hielo
Fusión. Mezcla. Hielo picado con agua salada
9.4. Cambios de estado
Recordemos que el estado de un sistema podía explicarse desde el punto de vista de la teoría cinética. Si se va comunicando calor a un sistema sólido la amplitud de los movimientos vibratorios de sus partículas va aumentando hasta que dicho sistema se convierte en líquido y si se sigue haciendo lo mismo acabará pasando a gas.
Por el contrario si a un gas le quitamos energía puede que llegue a transformarse en líquido y luego en sólido. A lo largo de estos procesos se cumple que la energía suministrada, al o por el sistema, va elevando o disminuyendo la temperatura del mismo teniendo en cuenta la expresión:
Q = m·Ce·ΔT
Debemos considerar que el calor específico de cada sustancia depende del estado en que se encuentre, de la temperatura, aunque a veces puede considerarse constante sin cometer mucho error.
No obstante cuando se está produciendo un cambio de estado toda la energía suministrada, al o por el sistema, se emplea en ese cambio de estado por lo que la temperatura del sistema, mientras se está produciendo el cambio de estado permanece constante.
Se llama calor latente de fusión al calor que se absorbe por unidad de masa de una sustancia cuando esta pasa de sólido a líquido. El calor latente de vaporización es el calor absorbido por unidad de masa del sistema cuando este pasa de líquido a gas. Para cada substancia tiene un valor determinado, así, en el caso del agua el calor latente de fusión es 3,335·105 J/kg y el de vaporización de 2,257·106 J/kg
donde L es el calor latente de cambio de estado, que representa el calor necesario para que un kg de masa de una sustancia cambie por completo de estado a la temperatura correspondiente. Su unidad en el SI es J/kg. También se puede expresar en cal/ g.
En ocasiones, el calor absorbido o cedido por un sistema material puede provocar un cambio de estado. En ese caso, el calor necesario para que una masa m de cierta sustancia cambie de estado es:
Q = m L
donde L es el calor latente de cambio de estado, que representa el calor necesario para que un kg de masa de una sustancia cambie por completo de estado a la temperatura correspondiente. Su unidad en el SI es J/kg. También se puede expresar en cal/ g.
Tabla de calores latentes
| ||
| Sustancia |
Calor latente de fusión
L f (J/kg) |
Calor latente de vaporización
Lv(J/kg) |
| Agua |
3,35•105
|
2,2•106
|
| Aluminio |
4•105
|
1,23•107
|
| Hierro |
2,75•105
|
6,29•106
|
| Cobre |
2,05•105
|
4,8•106
|
| Mercurio |
1,1•104
|
0,29•106
|
ANIMACIONES
10. TEORÍA CINÉTICA
E
En 1738 Daniel Bernouilli dedujo la Ley de Boyle aplicando a las moléculas las leyes del movimiento de Newton, pero su trabajo fue ignorado durante más de un siglo.
Los experimentos de Joule demostrando que el calor es una forma de energía hicieron renacer las ideas sostenidas por Bernouilli y en el período entre 1848 y 1898, Joule, Clausius, Maxwell y Boltzmann desarrollaron la teoría cinético-molecular, también llamada teoría cinética de los gases, que se basa en la idea de que todos los gases se comportan de la misma manera en lo referente al movimiento molecular .
En 1905 Einstein aplicó la teoría cinética al movimiento browniano de una partícula pequeña inmersa en un fluido y sus ecuaciones fueron confirmadas por los experimentos de Perrín en 1908, convenciendo de esta forma a los energéticos de la realidad de los átomos. La teoría cinética de los gases utiliza una descripción molecular para explicar el comportamiento macroscópico de la materia y se basa en los siguientes postulados:
Para poder explicar (ver preguntas) y entender el comportamiento de la materia existe un modelo teórico que se basa en los siguientes postulados:
En 1738 Daniel Bernouilli dedujo la Ley de Boyle aplicando a las moléculas las leyes del movimiento de Newton, pero su trabajo fue ignorado durante más de un siglo.
Los experimentos de Joule demostrando que el calor es una forma de energía hicieron renacer las ideas sostenidas por Bernouilli y en el período entre 1848 y 1898, Joule, Clausius, Maxwell y Boltzmann desarrollaron la teoría cinético-molecular, también llamada teoría cinética de los gases, que se basa en la idea de que todos los gases se comportan de la misma manera en lo referente al movimiento molecular .
En 1905 Einstein aplicó la teoría cinética al movimiento browniano de una partícula pequeña inmersa en un fluido y sus ecuaciones fueron confirmadas por los experimentos de Perrín en 1908, convenciendo de esta forma a los energéticos de la realidad de los átomos. La teoría cinética de los gases utiliza una descripción molecular para explicar el comportamiento macroscópico de la materia y se basa en los siguientes postulados:
Para poder explicar (ver preguntas) y entender el comportamiento de la materia existe un modelo teórico que se basa en los siguientes postulados:
- La materia está formada por pequeñas partículas (átomos, moléculas…)
- Entre las partículas que forman la materia no existe nada. Hay vacío.
- Existen unas fuerzas atractivas que tienden a juntar las partículas.
- Las partículas que forma un sistema material no están quietas, se mueven. La energía que poseen es proporcional a la temperatura. Esto es, si la temperatura es baja su movimiento será lento. Si la temperatura asciende se mueven más rápidamente.
| Movimiento browniano |
11. LEY DE AVOGADRO
Esta ley, descubierta por Avogadro a principios del siglo XIX, establece la relación entre la cantidad de gas y su volumen cuando se mantienen constantes la temperatura y la presión. Recuerda que la cantidad de gas la medimos en moles.
El volumen es directamente proporcional a la cantidad de gas:
- Si aumentamos la cantidad de gas, aumentará el volumen.
- Si disminuimos la cantidad de gas, el volumen disminuye.
Vamos a suponer que aumentamos la cantidad de gas. Esto quiere decir que al haber mayor número de moléculas aumentará la frecuencia de los choques con las paredes del recipiente lo que implica (por un instante) que la presión dentro del recipiente es mayor que la exterior y esto provoca que el émbolo se desplace hacia arriba inmediatamente. Al haber ahora mayor distancia entre las paredes (es decir, mayor volumen del recipiente) el número de choques de las moléculas contra las paredes disminuye y la presión vuelve a su valor original.
Según hemos visto en la animación anterior, también podemos expresar la ley de Avogadro así:
(el cociente entre el volumen y la cantidad de gas es constante)
Supongamos que tenemos una cierta cantidad de gas n1 que ocupa un volumen V1 al comienzo del experimento. Si variamos la cantidad de gas hasta un nuevo valor n2, entonces el volumen cambiará a V2, y se cumplirá:
que es otra manera de expresar la ley de Avogadro.
Ejemplo: Sabemos que 3.50 L de un gas contienen 0.875 mol. Si aumentamos la cantidad de gas hasta 1.40 mol, ¿cuál será el nuevo volumen del gas? (a temperatura y presión constantes)
Solución: Usamos la ecuación de la ley de Avogadro : V1 . n2 = V2 . n1
(3.50 L) . (1.40 mol) = (V2) . (0.875 mol)
Comprueba que si despejamos V2 obtenemos un valor de 5.60 L
ANIMACIÓN

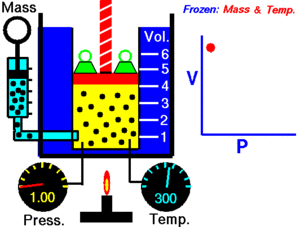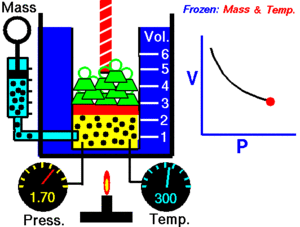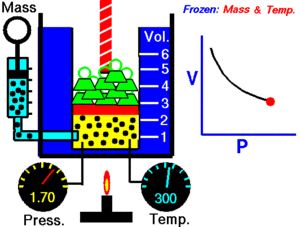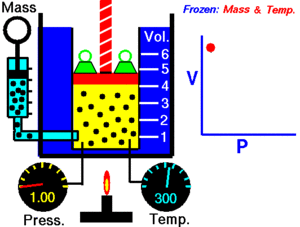
12. LEY DE BOYLE
Fue descubierta por Robert Boyle en 1662. Edme Mariotte también llegó a la misma conclusión que Boyle, pero no publicó sus trabajos hasta 1676. Esta es la razón por la que en muchos libros encontramos esta ley con el nombre de Ley de Boyle y Mariotte.
La ley de Boyle establece que la presión de un gas en un recipiente cerrado es inversamente proporcional al volumen del recipiente, cuando la temperatura es constante.
El volumen es inversamente proporcional a la presión:
- Si la presión aumenta, el volumen disminuye.
- Si la presión disminuye, el volumen aumenta.
Al aumentar el volumen, las partículas (átomos o moléculas) del gas tardan más en llegar a las paredes del recipiente y por lo tanto chocan menos veces por unidad de tiempo contra ellas. Esto significa que la presión será menor ya que ésta representa la frecuencia de choques del gas contra las paredes.
Cuando disminuye el volumen la distancia que tienen que recorrer las partículas es menor y por tanto se producen más choques en cada unidad de tiempo: aumenta la presión.
Lo que Boyle descubrió es que si la cantidad de gas y la temperatura permanecen constantes, el producto de la presión por el volumen siempre tiene el mismo valor.
Como hemos visto, la expresión matemática de esta ley es:
(el producto de la presión por el volumen es constante)
Supongamos que tenemos un cierto volumen de gas V1 que se encuentra a una presión P1 al comienzo del experimento. Si variamos el volumen de gas hasta un nuevo valor V2, entonces la presión cambiará a P2, y se cumplirá:
Ejemplo: 4.0 L de un gas están a 600.0 mmHg de presión. ¿Cuál será su nuevo volumen si aumentamos la presión hasta 800.0 mmHg?
Solución: Sustituimos los valores en la ecuación P1 . V1 = P2 . V2.
(600.0 mmHg) . (4.0 L) =(800.0 mmHg) . (V2)
Si despejas V2 obtendrás un valor para el nuevo volumen de 3L.




| Ley de Boyle Laboratorio virtual para estudiar la ley de Boyle |
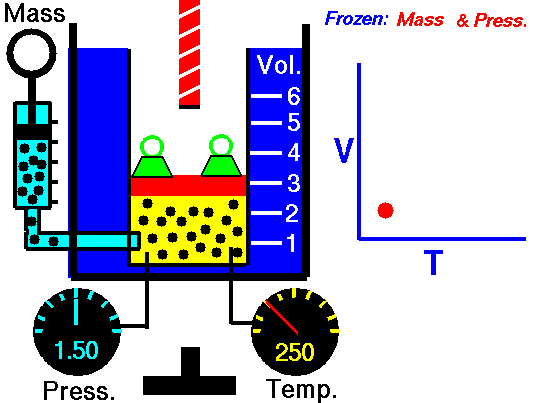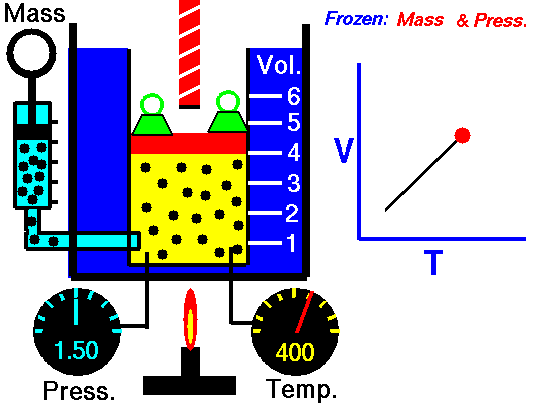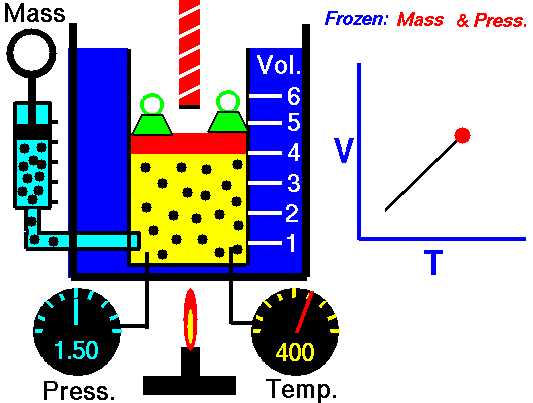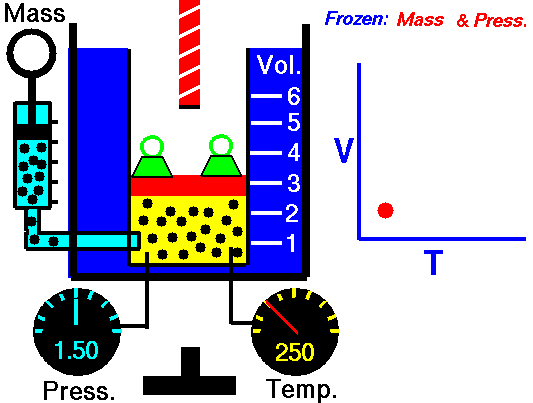
13. LEY DE CHARLES
El volumen es directamente proporcional a la temperatura del gas:
- Si la temperatura aumenta, el volumen del gas aumenta.
- Si la temperatura del gas disminuye, el volumen disminuye.
Cuando aumentamos la temperatura del gas las moléculas se mueven con más rapidez y tardan menos tiempo en alcanzar las paredes del recipiente. Esto quiere decir que el número de choques por unidad de tiempo será mayor. Es decir se producirá un aumento (por un instante) de la presión en el interior del recipiente y aumentará el volumen (el émbolo se desplazará hacia arriba hasta que la presión se iguale con la exterior).
Lo que Charles descubrió es que si la cantidad de gas y la presión permanecen constantes, el cociente entre el volumen y la temperatura siempre tiene el mismo valor.
Matemáticamente podemos expresarlo así:
(el cociente entre el volumen y la temperatura es constante)
Supongamos que tenemos un cierto volumen de gas V1 que se encuentra a una temperatura T1 al comienzo del experimento. Si variamos el volumen de gas hasta un nuevo valor V2, entonces la temperatura cambiará a T2, y se cumplirá:
que es otra manera de expresar la ley de Charles.
Esta ley se descubre casi ciento cuarenta años después de la de Boyle debido a que cuando Charles la enunció se encontró con el inconveniente de tener que relacionar el volumen con la temperatura Celsius ya que aún no existía la escala absoluta de temperatura.
Ejemplo: Un gas tiene un volumen de 2.5 L a 25 °C. ¿Cuál será su nuevo volumen si bajamos la temperatura a 10 °C?
Recuerda que en estos ejercicios siempre hay que usar la escala Kelvin.
Solución: Primero expresamos la temperatura en kelvin:
T1 = (25 + 273) K= 298 K
T2 = (10 + 273 ) K= 283 K
Ahora sustituimos los datos en la ecuación:
2.5L
|
V2
| |
-----
|
=
|
-----
|
298 K
|
283 K
|
Si despejas V2 obtendrás un valor para el nuevo volumen de 2.37 L.
ANIMACIONES




14. LEY DE GAY-LUSSAC
Fue enunciada por Joseph Louis Gay-Lussac a principios de 1800. Establece la relación entre la temperatura y la presión de un gas cuando el volumen es constante.
La presión del gas es directamente proporcional a su temperatura
- Si aumentamos la temperatura, aumentará la presión.
- Si disminuimos la temperatura, disminuirá la presión.
Al aumentar la temperatura las moléculas del gas se mueven más rápidamente y por tanto aumenta el número de choques contra las paredes, es decir aumenta la presión ya que el recipiente es de paredes fijas y su volumen no puede cambiar.
Gay-Lussac descubrió que, en cualquier momento de este proceso, el cociente entre la presión y la temperatura siempre tenía el mismo valor:
(el cociente entre la presión y la temperatura es constante)
Supongamos que tenemos un gas que se encuentra a una presión P1 y a una temperatura T1 al comienzo del experimento. Si variamos la temperatura hasta un nuevo valor T2, entonces la presión cambiará a P2, y se cumplirá:
Supongamos que tenemos un gas que se encuentra a una presión P1 y a una temperatura T1 al comienzo del experimento. Si variamos la temperatura hasta un nuevo valor T2, entonces la presión cambiará a P2, y se cumplirá:
que
es otra manera de expresar la ley de Gay-Lussac.
Esta ley, al igual que la de Charles, está expresada en función de la temperatura absoluta. Al igual que en la ley de Charles, las temperaturas han de expresarse en Kelvin.
Ejemplo: Cierto volumen de un gas se encuentra a una presión de 970 mmHg cuando su temperatura es de 25.0°C. ¿A qué temperatura deberá estar para que su presión sea 760 mmHg?
Solución: Primero expresamos la temperatura en kelvin:
T1 = (25 + 273) K = 298 K
es otra manera de expresar la ley de Gay-Lussac.
Esta ley, al igual que la de Charles, está expresada en función de la temperatura absoluta. Al igual que en la ley de Charles, las temperaturas han de expresarse en Kelvin.
Ejemplo: Cierto volumen de un gas se encuentra a una presión de 970 mmHg cuando su temperatura es de 25.0°C. ¿A qué temperatura deberá estar para que su presión sea 760 mmHg?
Solución: Primero expresamos la temperatura en kelvin:
T1 = (25 + 273) K = 298 K
Ahora sustituimos los datos en la ecuación:
970 mmHg
|
760 mmHg
| |
------------
|
=
|
------------
|
298 K
|
T2
|
Si despejas T2 obtendrás que la nueva temperatura deberá ser 233.5 K o lo que es lo mismo -39.5 °C.
ANIMACIONES
ANIMACIONES
Un gas ideal es un gas teórico compuesto de un conjunto de partículas puntuales con desplazamiento aleatorio que no interactúan entre sí. El concepto de gas ideal es útil porque comporta una ecuación de estado simplificada, y puede ser analizada mediante la mecánica estadística.
Enunciamos sus características :
- Las partículas del gas son pequeñísimas comparadas con el volumen del recipiente.
- Se mueven al azar con distintas velocidades de manera que, si aumenta la temperatura, aumenta la velocidad de las partículas del gas.
- No existen fuerzas de atracción entre ellas.
- En su movimiento chocan entre ellas y con las paredes del recipiente, cumpliéndose las leyes de los choques elásticos.
- Cuando chocan aparecen las fuerzas o interacciones entre ellas o con las paredes del recipiente.
- Los choques con las paredes del recipiente producen el efecto que llamamos presión sobre las mismas.
- n = número de moles
- R = constante universal de gas = 8.3145 J/mol K
- N = número de moléculas
- k = constante de Boltzmann = 1.38066 x 10-23 J/K = 8.617385 x 10-5eV/K
- k = R/NA
- NA = número de Avogadro = 6.0221 x 1023 /mol
Pero también hay un elemento estadístico en la determinación de la energía cinética media de esas moléculas. La temperatura se considera proporcional a la energía cinética media; lo cual invoca la idea de temperatura cinética. Una mol de gas ideal a TPE (temperatura y presión estándares), ocupa 22,4 litros.
Isobara | Isocora | Isoterma |
ANIMACIONES






Observa en qué consisten las transformaciones isocoras, adiabáticas, isotermas e isobaras.
Observa debajo de la curva el trabajo realizado en una transformación a temperatura constante.
| Ley de los gases ideales Aprende cómo se deduce la ley de los gases ideales y cómo se calcula el valor de la constante R. |
16. LEY DE LAS PRESIONES PARCIALES O LEY DE DALTON
La presión parcial de un gas, en atmósferas, en una mezcla o solución, sería aproximadamente la presión de dicho gas si se eliminaran repentinamente todos los demás componentes de la mezcla o solución y sin que hubiese variación de temperatura. La presión parcial de un gas en una mezcla es la medida de la actividad termodinámica de las moléculas de dicho gas y, por lo tanto, es proporcional a la temperatura y concentración del mismo.
La presión parcial de un gas ideal en una mezcla es igual a la presión que ejercería en caso de ocupar él solo el mismo volumen a la misma temperatura. Esto sucede porque las moléculas de un gas ideal están tan alejadas unas de otras que no interactúan entre ellas. La mayoría de los gases reales se acerca bastante a este modelo.
Como consecuencia de esto, la presión total, es decir la suma de todas estas presiones, de una mezcla en equilibrio es igual a la suma de las presiones parciales de los gases presentes. Por ejemplo, para la reacción dada:N2 + 3H2 ↔ 2NH3
La presión total es igual a la suma de las presiones parciales individuales de los gases que forman la mezcla:

Donde P es la presión total de la mezcla y Px denota la presión parcial de x.
Para calcular la presión parcial de un gas basta con multiplicar su fracción molar por la presión total de la mezcla. Es decir:

Si se disminuye el volumen del recipiente, la presión total de los gases aumenta. Por ser la reacción reversible, la posición de equilibrio se mueve hacia el lado de la reacción con un menor número de moles (en este caso, el producto del lado derecho).
17. LEY DE HENRY
Cuando se expone un líquido a un gas, las moléculas del gas se disolverán en el líquido.
Ley de Henry
La ley de Henry se puede usar para determinar la presión parcial de un gas en el seno de un fluido.

Por ejemplo, a 50 metros de profundidad (165 pies), la presión absoluta es de 6 bar (1 bar correspondiente a la presión atmosférica + 5 bar por la debida al agua) y la presión parcial de los componentes principales del aire, 21 % oxígeno y 79 % nitrógeno son:
P(N2) = 6 bar x 0,79 = 4,74 barP(O2) = 6 bar x 0,21 = 1,26 bar
ANIMACIONES

18. PROBLEMAS





19. PRÁCTICAS

Gases y volumen
20. CUESTIONES






























No hay comentarios:
Publicar un comentario