ÍNDICE
|
14. Segundo principio de la termodinámica
15. Relación entre la energía y la velocidad de reacción 1. Velocidad de reacción 2. Presencia de catalizadores
16. Mecanismos de reacción
1. Teoría de las colisiones
17. Notación de las reacciones químicas
1. Justificación del ajuste químico
1. Método de ajuste por tanteo
2. Por coeficientes indeterminados
3. Cálculos estequiométricos
18. Reactivo limitante
1. Rendimiento 2. Conceptos
19. Tipos de reacciones químicas
1. Síntesis
2. Descomposición
3. Sustitución o desplazamiento
4. Intercambio
5. Neutralización
6. Combustión
7. Otras formas de clasificación
8. Peligrosidad de las sustancias químicas 20. Procesos químicos industriales 21. Problemas
22. Prácticas
23. Cuestiones
24. Otros contenidos
25. Vídeos
|
1. ESQUEMAS

2. PRESENTACIONES






REACCIONES QUÍMICAS
REACCIONES QUÍMICAS
3. CONTENIDOS ANIMADOS





4. TIPOS DE SISTEMAS
Los sistemas químicos pueden clasificarse en:
- Sistema Aislado. No hay intercambio de materia ni de energía con el exterior.
- Sistema Cerrado. No hay intercambio de materia pero sí de energía.
- Sistema abierto. El intercambio con el exterior es de materia y de energía.

Y también se dividen en:
- Sistemas homogéneos. los que están formados por una sola fase (sólido - líquido - gas).
- Sistemas heterogéneos. en el que coexisten varias fases.
4. CAMBIOS FÍSICOS Y QUÍMICOS
En la naturaleza se producen continuamente cambios o transformaciones. Vamos a clasificar estos cambios en dos tipos: químicos y físicos.
Cambios químicos: Son aquellos en los que unas sustancias se transforman en otras sustancias diferentes, con naturaleza y propiedades distintas. Por ejemplo se producen cambios químicos cuando una sustancia arde, se oxida o se descompone.
Cambios físicos: Son todos aquellos en los que ninguna sustancia se transforma en otra diferente. Por ejemplo se producen cambios físicos cuando una sustancia se mueve, se le aplica una fuerza o se deforma.Aquí tienes algunos ejemplos más de cambios físicos:
ANIMACIONES


6. REACTIVOS Y PRODUCTOS
En los cambios químicos se produce la transformación de unas sustancias en otras diferentes y por lo tanto pueden tener propiedades diferentes. En la escena de la derecha se ilustra el cambio que es produce cuando se transforman los reactivos en productos. Es conveniente aclarar que no siempre que se produce una reacción hay cambio de color, ya que hay casos en los que reactivos y productos pueden tener colores iguales.
Las sustancias que hay antes de producirse el cambio y que desaparecen se llaman REACTIVOS.
Las sustancias que hay después de producirse el cambio y que aparecen o se generan se llaman PRODUCTOS.
Los reactivos y productos de una reacción química pueden encontrarse en diferentes estados. Estos se indican poniendo detrás del nombre o la fórmula de la sustancia y entre paréntesis la notación siguiente:
- Sustancias sólidas (s)
- Sustancias líquidas (l)
- Sustancias gaseosas (g)
- Sustancias disueltas en agua (ac)
También se usa una flecha hacia arriba cuando una sustancia gaseosa se libera y una flecha hacia abajo cuando una sustancia solidifica.
7. CAMBIOS QUÍMICOS A NIVEL MOLECULAR
Llegado a este punto nos preguntamos por qué ocurren los cambios químicos, por qué unas sustancias se transforman en otras diferentes.
Sabemos que los átomos de los reactivos están unidos entre sí formando compuestos químicos.
Cuando se produce un cambio químico, serompen determinados enlaces de los reactivos y se forman nuevos enlaces en los productos.
Por tanto, un cambio químico consiste en un proceso en el que los átomos cambian la forma en la que se unen.
7.1. Mecanismo de reacción
Hemos comentado que en las reacciones químicas se producen procesos de ruptura y formación de enlaces químicos.
La descripción detallada de todo el proceso, que a nivel atómico se produce durante una reacción química, se conoce con el nombre de mecanismo de reacción.
Por tanto, el mecanismo de una reacción no es más que explicar con el mayor detalle posible como se producen los cambios de los reactivos para llegar a los productos. Esto implica indicar la posición de los átomos y la formación y ruptura de los enlaces a lo largo del proceso de reacción.
Las propiedades de las sustancias químicas dependen fundamentalmente de tres aspectos:



ANIMACIONES

Reactivos, productos y sobrantes (PhET)

11.2. Conservación de la masa
Si tuviéramos que decidir cuál es la ley o principio más importante en el campo de la Química no cabría ninguna duda, el principio de consevación de la masa o ley de Lavoisier. Y no por su complejidad, que no tiene ninguna, sino porque su establecimiento, a finales del siglo XVIII, marcó el nacimiento de la química moderna y el abandono de su predecesora, la alquimia. y por ello a su autor, el francés Antoine-Laurent Lavoisier ( 1743-1794) se le conoce como el padre de la química.
Se puede enunciar de distintas formas:
La materia ni se crea ni se destruye, sólo se transforma.
En una reacción química la suma de la masa de los reactivos es igual a la suma de la masa de los productos.
En una reacción química los átomos no desaparecen, simplemente se ordenan de otra manera.
Aunque te pueda parecer muy lógica y sensata esta idea, y que no tiene mucho mérito haber llegado a esa conclusión, Lavoisier tuvo que realizar numerosos y meticulosos experimentos para convencer a los que por entonces pensaban que al calentar un metal este ganaba masa cuando se convertía en una nueva sustancia. Lavoisier midió en un recipiente cerrado las masas del sólido y el aire antes y después de la combustión y llegó a la conclusión de quela masa que ganaba el metal era igual a la masa de aire que se perdía.



Relaciones molares
Cambios químicos: Son aquellos en los que unas sustancias se transforman en otras sustancias diferentes, con naturaleza y propiedades distintas. Por ejemplo se producen cambios químicos cuando una sustancia arde, se oxida o se descompone.
Cambios físicos: Son todos aquellos en los que ninguna sustancia se transforma en otra diferente. Por ejemplo se producen cambios físicos cuando una sustancia se mueve, se le aplica una fuerza o se deforma.Aquí tienes algunos ejemplos más de cambios físicos:
|
ANIMACIONES


6. REACTIVOS Y PRODUCTOS
En los cambios químicos se produce la transformación de unas sustancias en otras diferentes y por lo tanto pueden tener propiedades diferentes. En la escena de la derecha se ilustra el cambio que es produce cuando se transforman los reactivos en productos. Es conveniente aclarar que no siempre que se produce una reacción hay cambio de color, ya que hay casos en los que reactivos y productos pueden tener colores iguales.
Las sustancias que hay antes de producirse el cambio y que desaparecen se llaman REACTIVOS.
Las sustancias que hay después de producirse el cambio y que aparecen o se generan se llaman PRODUCTOS.
Los reactivos y productos de una reacción química pueden encontrarse en diferentes estados. Estos se indican poniendo detrás del nombre o la fórmula de la sustancia y entre paréntesis la notación siguiente:
- Sustancias sólidas (s)
- Sustancias líquidas (l)
- Sustancias gaseosas (g)
- Sustancias disueltas en agua (ac)
También se usa una flecha hacia arriba cuando una sustancia gaseosa se libera y una flecha hacia abajo cuando una sustancia solidifica.
7. CAMBIOS QUÍMICOS A NIVEL MOLECULAR
Llegado a este punto nos preguntamos por qué ocurren los cambios químicos, por qué unas sustancias se transforman en otras diferentes.
Sabemos que los átomos de los reactivos están unidos entre sí formando compuestos químicos.
Cuando se produce un cambio químico, serompen determinados enlaces de los reactivos y se forman nuevos enlaces en los productos.
Por tanto, un cambio químico consiste en un proceso en el que los átomos cambian la forma en la que se unen.
7.1. Mecanismo de reacción
Hemos comentado que en las reacciones químicas se producen procesos de ruptura y formación de enlaces químicos.
La descripción detallada de todo el proceso, que a nivel atómico se produce durante una reacción química, se conoce con el nombre de mecanismo de reacción.
Por tanto, el mecanismo de una reacción no es más que explicar con el mayor detalle posible como se producen los cambios de los reactivos para llegar a los productos. Esto implica indicar la posición de los átomos y la formación y ruptura de los enlaces a lo largo del proceso de reacción.
Las propiedades de las sustancias químicas dependen fundamentalmente de tres aspectos:
- el número y tipo de átomos o elementos que las constituyen
- de los enlaces que los unen
- de la disposición espacial de los átomos en el espacio.
ANIMACIONES

Reactivos, productos y sobrantes (PhET)
8. FÓRMULAS DE SUSTANCIAS
Los compuestos químicos se representan mediante fórmulas. Dependiendo de la información que nos den, tenemos diferentes tipos de fórmulas. Pasamos a comentarlas y tomaremos como ejemplo el agua oxigenada.
Fórmula empírica
|
Nos indica la proporción o relación en la que participan los elementos en el compuesto. En el agua oxigenada hay un átomo de hidrógeno por cada átomo de oxígeno.
|
HO
|
Fórmula molecular
|
Nos indica el número exacto de átomos de cada clase que contiene la sustancia. Una molécula de agua oxigenada tiene dos átomos de hidrógeno y dos de oxígeno.
|
H2O2
|
Fórmula desarrollada
|
Con esta formula sabemos además del número y tipo de átomos de cada clase y la forma en la que estos se unen. En nuestro ejemplo se une un átomo de hidrógeno a uno de oxígeno, éste a su vez se une a otro oxígeno que también se une a otro hidrógeno.
|
H-O-O-H
|
Fórmula espacial
|
Esta es la fórmula más detallada y además de darnos la información de las anteriores, nos da la posición que cada uno de los átomos ocupa en el espacio. En nuestro caso la molécula presenta tres átomos en un plano (HOO) y cuarto (H) está fuera de este plano con un ángulo en torno a 98º. La distancia entre los oxígenos está sobre 1.46 Å y la distancia hidrógeno oxígeno es aproximadamente 0.95 Å.
|
9. MAGNITUDES MÁSICAS
9.1. Masa molecular
Los elementos químicos se pueden unir mediante enlaces químicos formado moléculas. Para calcular la masa molecularde un compuesto se suma la masa en uma de cada uno de sus elementos.
9.1. Masa molecular
Los elementos químicos se pueden unir mediante enlaces químicos formado moléculas. Para calcular la masa molecularde un compuesto se suma la masa en uma de cada uno de sus elementos.
Ej.: Mm(H2O) = 18 uma, Mm(H2) = 2 uma, Mm(CO2) = 44 uma.
Otra posibilidad es que los elementos se unan formando sólidos. Los sólidos (que están formados por muchos átomos) se representan mediante una fórmula que indica la proporción en la que participan los diferentes elementos en el compuesto (masa fórmula).
Otra posibilidad es que los elementos se unan formando sólidos. Los sólidos (que están formados por muchos átomos) se representan mediante una fórmula que indica la proporción en la que participan los diferentes elementos en el compuesto (masa fórmula).
Ejemplo: la masa formula del NaCl (sólido iónico) se calcula sumando la masa del sodio (23 uma) y la del cloro (35,5 uma), por tanto es de 58,5 uma.
A efectos prácticos la masa de moléculas y sólidos se hace de la misma forma, sumando la masa de los elementos de su fórmula.
9.2. Masa atómica gramo
Para medir la masa de los átomos, al ser muy pequeña, utilizamos una unidad muy pequeña, la uma. Con ella medimos la masa de todos los elementos de la Tabla Periódica.
Sin embargo, esta unidad, al ser tan pequeña, no es una unidad práctica para usar en laboratorio. Por ello, los científicos han elaborado una lista de masas atómicas en gramos. Es decir, han cogido la lista de masas atómicas en uma, han dejado los mismos números, pero han cambiado la unidad uma por otra mucho más grande, el gramo.
Cuando expresamos la masa atómica en uma nos referimos a la masa de un átomo de ese elemento. Cuando expresamos la masa atómica en gramos, tenemos que coger muchos átomos de ese elemento (más adelante veremos cuantos) y se dice que tenemos un mol de átomos del mismo.
1 gramo hay 602409638554216867469876 uma. Se puede ver que un gramo contiene muchas uma.
9.3. Masa molecular gramo
Igualmente que como ocurre con los átomos, la masa de una molécula es muy pequeña y también se miden en uma.
De igual manera, y por cuestiones prácticas la masa de las moléculas se expresa en gramos. Cuando expresamos la masa molecular en uma nos referimos a la masa de una molécula. Cuando expresamos la masa molecular en gramos, tenemos que coger muchas moléculas de ese compuesto o elemento (más adelante veremos cuantas) y se dice que tenemos un mol de moléculas de la misma.
Las masas molares de una molécula se calculan sumando las masas molares de todos y cada uno de los átomos que forman parte de la molécula del compuesto o elemento.
9.4. Composición porcentual a partir de las fórmulas
 Calcule el peso fórmula de y su porcentaje de composición, es decir el porcentaje de hidrógeno y oxígeno que hay en la molécula:
Calcule el peso fórmula de y su porcentaje de composición, es decir el porcentaje de hidrógeno y oxígeno que hay en la molécula:
 H2O
H2O

 Ca(OH)2
Ca(OH)2

 Mg(NO3)2
Mg(NO3)2

9.5. Concepto de mol
ANIMACIONESA efectos prácticos la masa de moléculas y sólidos se hace de la misma forma, sumando la masa de los elementos de su fórmula.
9.2. Masa atómica gramo
Para medir la masa de los átomos, al ser muy pequeña, utilizamos una unidad muy pequeña, la uma. Con ella medimos la masa de todos los elementos de la Tabla Periódica.
Sin embargo, esta unidad, al ser tan pequeña, no es una unidad práctica para usar en laboratorio. Por ello, los científicos han elaborado una lista de masas atómicas en gramos. Es decir, han cogido la lista de masas atómicas en uma, han dejado los mismos números, pero han cambiado la unidad uma por otra mucho más grande, el gramo.
Cuando expresamos la masa atómica en uma nos referimos a la masa de un átomo de ese elemento. Cuando expresamos la masa atómica en gramos, tenemos que coger muchos átomos de ese elemento (más adelante veremos cuantos) y se dice que tenemos un mol de átomos del mismo.
1 gramo hay 602409638554216867469876 uma. Se puede ver que un gramo contiene muchas uma.
9.3. Masa molecular gramo
Igualmente que como ocurre con los átomos, la masa de una molécula es muy pequeña y también se miden en uma.
De igual manera, y por cuestiones prácticas la masa de las moléculas se expresa en gramos. Cuando expresamos la masa molecular en uma nos referimos a la masa de una molécula. Cuando expresamos la masa molecular en gramos, tenemos que coger muchas moléculas de ese compuesto o elemento (más adelante veremos cuantas) y se dice que tenemos un mol de moléculas de la misma.
Las masas molares de una molécula se calculan sumando las masas molares de todos y cada uno de los átomos que forman parte de la molécula del compuesto o elemento.
9.4. Composición porcentual a partir de las fórmulas
A veces al analizar una sustancia, es importante conocer el porcentaje en masa de cada uno de los elementos de un compuesto.
Usaremos de ejemplo al metano: CH4
Peso fórmula y molecular:
[1 x (12,011 uma)] + [4 x (1,008)] = 16,043 uma
%C = 1 x (12,011 uma)/16,043 uma = 0,749 = 74,9%
%H = 4 x (1,008 uma)/16,043 uma = 0,251 = 25,1%
El número 6,02. 10 23 es muy importante en química. Recibe el nombre de Número o Constante de Avogadro (NA)
Es el número de átomos de C que hay que reunir para que su masa sea igual a 12,0 g (el valor de la masa atómica en gramos). Por tanto:
Masa de 1 átomo de C: 12,0 u
Masa de 6,02.1023 átomos de C: 12,0 g
Comparemos ahora las masas de un átomo de C y uno de H:
Masa de 1 átomo de C : 12 u
Masa de 1 átomo de H: 1 u
Observa que un átomo de H tiene una masa 12 veces inferior a uno de C.
Si ahora tomamos 6,02.1023 átomos de C y el mismo número de átomos de H, resultará que éstos tendrán una masa 12 veces menor:
Masa de 6,02.1023 átomos de C: 12,0 g
Masa de 6,02.1023 átomos de H: 1,0 g
Si repetimos este razonamiento para otros átomos llegaríamos a idénticas conclusiones:
Masa de 6,02.1023 átomos de O: 16,0 g
Masa de 6,02.1023 átomos de N: 14,0 g
Y lo mismo pasaría si extendemos el razonamiento a moléculas:
Masa de 6,02.1023 moléculas de H2O : 18,0 g
Masa de 6,02.1023 moléculas de CO2 : 44,0 g
Se define el mol como la cantidad de sustancia que contiene 6,02.1023 unidades elementales.
Cuando se usa el mol las unidades elementales deben ser especificadas, pudiendo ser átomos, moléculas, iones…
El mol es la unidad de cantidad de materia del Sistema Internacional de Unidades (S.I.)
La masa de un mol en gramos es igual al valor de la masa atómica o molecular.
 Calcular el número de moles de NaOH en 85.0 gr de NaOH
Calcular el número de moles de NaOH en 85.0 gr de NaOH

 Calcular la masa en gramos de 0.720 moles de Ca3(PO4)2.
Calcular la masa en gramos de 0.720 moles de Ca3(PO4)2.

 Calcular el número de moléculas que hay en 24.5 g de CO2.
Calcular el número de moléculas que hay en 24.5 g de CO2.

 Calcular la masa en gramos de un átomo de carbono-12.
Calcular la masa en gramos de un átomo de carbono-12.

 Calcular la masa en kilogramos de 3.25 mmoles de H2O.
Calcular la masa en kilogramos de 3.25 mmoles de H2O.

 Calcular el número de átomos de hidrógeno en 0.25 mg de H2.
Calcular el número de átomos de hidrógeno en 0.25 mg de H2.

Ejemplo 1 ¿Cuántos moles son:
a) 7,0 g de Na?
b) 20,5 g de H2O?
c) 64,8 g de H2SO4?

 Solución:
Solución:
9.6. Interconversión entre masas, moles y número de partículas
Es necesario rastrear las unidades en los cálculos de interconversión de masas a moles.
A esto lo conocemos formalmente con el nombre de análisis dimensional.
Ejemplo: Calcular la masa de 1,5 moles de cloruro de calcio
Fórmula química del cloruro de calcio = CaCl2
Masa atómica del Ca = 40,078 uma
Masa atómica del Cl = 35,453 uma
Al ser un compuesto iónico no tiene peso molecular, sino peso fórmula..
Peso fórmula del CaCl2 = (40,078) + 2(35,453) = 110,984 uma
De manera que, un mol de CaCl2 tendrá una masa de 110,984 gramos. Y entonces, 1,5 moles de CaCl2 pesarán:
Ejemplo: Si tuviera 2,8 gramos de oro, ¿cuántos átomos de oro tendría?
Fórmula del oro: Au
Peso fórmula del Au = 196,9665 uma
Por lo tanto, 1 mol de oro pesa 196,9665 gramos.
De manera que, en 2,8 gramos de oro habrá:
Sabemos por medio del número de Avogadro que hay aproximadamente 6,02 x 1023 atomos/mol.
Por lo cual, en 0,0142 moles tendremos:
(0,0142 moles)(6,02x1023atomos/moles)=8,56x1021 átomos
9.7. Fórmula empírica a partir del análisis elemental
Una fórmula empírica nos indica las proporciones relativas de los diferentes átomos de un compuesto.
Estas proporciones son ciertas también a nivel molar.
Entonces, el H2O tiene dos átomos de hidrógeno y un átomo de oxígeno.
De la misma manera, 1,0 mol de H2O está compuesta de 2,0 moles de átomos de hidrógeno y 1,0 mol de átomos de oxígeno.
También podemos trabajar a la inversa a partir de las proporciones molares:
Si conocemos las cantidades molares de cada elemento en un compuesto, podemos determinar la fórmula empírica.
El mercurio forma un compuesto con el cloro que tiene 73,9% de mercurio y 26,1% de cloro en masa. ¿Cuál es su fórmula empírica?.
Supongamos que tenemos una muestra de 100 gramos de este compuesto. Entonces la muestra tendrá 73,9 gramos de mercurio y 26,1 gramos decloro.
¿Cuántas moles de cada átomo representan las masas individuales?
Para el mercurio: (73,9 g) x (1 mol/200,59 g) = 0,368 moles
Para el cloro: (26,1 g) x (1 mol/35,45 g) = 0,736 mol
¿Cuál es la proporción molar de los dos elementos?
Es decir, tenemos el doble de moles (o sea átomos) de Cl que de Hg. La fórmula empírica del compuesto sería: HgCl2
9.8. Fórmula molecular a partir de la fórmula empírica
La fórmula química de un compuesto obtenida por medio del análisis de sus elementos o de su composición siempre será la fórmula empírica.
Para poder obtener la fórmula molecular necesitamos conocer el peso molecular del compuesto.
La fórmula química siempre será algún múltiplo entero de la fórmula empírica (es decir, múltiplos enteros de los subíndices de la fórmula empírica).
La Vitamina C (ácido ascórbico) tiene 40,92 % de C y 4,58 % de H, en masa.
El resto, hasta completar el 100%, es decir el 54,50 %, es de O.
El peso molecular de este compuesto es de 176 uma. ¿Cuáles serán su fórmula molecular o química y su fórmula empírica?
En 100 gramos de ácido ascórbico tendremos:
(40,92 g de C) x (1 mol/12,011 g) = 3,407 moles de C
(4,58 g de H) x (1 mol/1,008 g) = 4,544 moles de H
(54,50 g de O) x (1 mol/15,999 g) = 3,406 moles de O
Para determinar la proporción simplemente dividimos entre la cantidad molar más pequeña (en este caso 3,406 o sea la del oxígeno):
1,333 es como 1 y 1/3, así que si multiplicamos las proporciones de cada átomo por 3 obtendremos valores enteros para todos los átomos.
Esta es la fórmula empírica para el ácido ascórbico. Pero, ¿y la fórmula molecular?
Nos dicen que el peso molecular de este compuesto es de 176 uma.
¿Cuál es el peso molecular de nuestra fórmula empírica?
El peso molecular de nuestra fórmula empírica es significativamente menor que el valor experimental.
¿Cuál será la proporción entre los dos valores?
Parece que la fórmula empírica pesa esencialmente la mitad que la molecular.
Si multiplicamos la fórmula empírica por dos, entonces la masa molecular será la correcta.
Entonces, la fórmula molecular será:
Es el número de átomos de C que hay que reunir para que su masa sea igual a 12,0 g (el valor de la masa atómica en gramos). Por tanto:
Masa de 1 átomo de C: 12,0 u
Masa de 6,02.1023 átomos de C: 12,0 g
Comparemos ahora las masas de un átomo de C y uno de H:
Masa de 1 átomo de C : 12 u
Masa de 1 átomo de H: 1 u
Observa que un átomo de H tiene una masa 12 veces inferior a uno de C.
Si ahora tomamos 6,02.1023 átomos de C y el mismo número de átomos de H, resultará que éstos tendrán una masa 12 veces menor:
Masa de 6,02.1023 átomos de C: 12,0 g
Masa de 6,02.1023 átomos de H: 1,0 g
Si repetimos este razonamiento para otros átomos llegaríamos a idénticas conclusiones:
Masa de 6,02.1023 átomos de O: 16,0 g
Masa de 6,02.1023 átomos de N: 14,0 g
Y lo mismo pasaría si extendemos el razonamiento a moléculas:
Masa de 6,02.1023 moléculas de H2O : 18,0 g
Masa de 6,02.1023 moléculas de CO2 : 44,0 g
Se define el mol como la cantidad de sustancia que contiene 6,02.1023 unidades elementales.
Cuando se usa el mol las unidades elementales deben ser especificadas, pudiendo ser átomos, moléculas, iones…
El mol es la unidad de cantidad de materia del Sistema Internacional de Unidades (S.I.)
La masa de un mol en gramos es igual al valor de la masa atómica o molecular.
¿Por qué es tan importante el mol?
El mol, tal como se ha dicho más arriba, es una de las unidades fundamentales del Sistema Internacional de Unidades (S.I.) y es, probablemente, la unidad más característica de la Química. Y es tan útil porque permite “contar” átomos o moléculas determinando la masa de sustancia.
Esto es básico porque las sustancias reaccionan en unas proporciones dadas.
Por ejemplo, dos moléculas de hidrógeno (gas) reaccionan con una de oxígeno (gas) para dar una molécula de agua:
Siempre que queramos obtener agua por reacción entre el hidrógeno y el oxígeno deberemos tomar ambos gases en la proporción de doble cantidad de moléculas de hidrógeno que de oxígeno. ¿Pero como “contar” las moléculas”?... usando el concepto de mol:
Un mol de hidrógeno, contiene el mismo número de moléculas de H2 que tiene un mol de O2: 6,02.10 23. Por tanto, para que reaccionen en proporción 2 :1 tendremos que coger 2 moles de H2 y 1 mol de O2 . O lo que es lo mismo 4,0 g de H2 y 32,0 g de O2 que se combinarán para dar 2 moles de H2O (36,0 g)
El mol, tal como se ha dicho más arriba, es una de las unidades fundamentales del Sistema Internacional de Unidades (S.I.) y es, probablemente, la unidad más característica de la Química. Y es tan útil porque permite “contar” átomos o moléculas determinando la masa de sustancia.
Esto es básico porque las sustancias reaccionan en unas proporciones dadas.
Por ejemplo, dos moléculas de hidrógeno (gas) reaccionan con una de oxígeno (gas) para dar una molécula de agua:
Siempre que queramos obtener agua por reacción entre el hidrógeno y el oxígeno deberemos tomar ambos gases en la proporción de doble cantidad de moléculas de hidrógeno que de oxígeno. ¿Pero como “contar” las moléculas”?... usando el concepto de mol:
Un mol de hidrógeno, contiene el mismo número de moléculas de H2 que tiene un mol de O2: 6,02.10 23. Por tanto, para que reaccionen en proporción 2 :1 tendremos que coger 2 moles de H2 y 1 mol de O2 . O lo que es lo mismo 4,0 g de H2 y 32,0 g de O2 que se combinarán para dar 2 moles de H2O (36,0 g)
Solución: El peso fórmula del NaOH es 40.0; por tanto hay 40.0 g en un mol. Entonces, el número de moles en 85.0 g de NaOH se calcula como:
Solución: El peso fórmula del Ca3(PO4)2 es 310 g. Entonces la masa de 0.720 moles se calcula como:
Solución:
Solución:
Solución:
Solución:
Ejemplo 1 ¿Cuántos moles son:
a) 7,0 g de Na?
b) 20,5 g de H2O?
c) 64,8 g de H2SO4?

 Solución:
Solución:
Ejemplo 2. Necesitamos tener:
a) 1,20 moles de Zn.
b) 0,25 moles de CH4
c) 3,40 moles de H2CO3
¿Cuántos gramos deberemos pesar de cada sustancia? Solución:
a) 1,20 moles de Zn.
b) 0,25 moles de CH4
c) 3,40 moles de H2CO3
¿Cuántos gramos deberemos pesar de cada sustancia? Solución:
Es necesario rastrear las unidades en los cálculos de interconversión de masas a moles.
A esto lo conocemos formalmente con el nombre de análisis dimensional.
Ejemplo: Calcular la masa de 1,5 moles de cloruro de calcio
Fórmula química del cloruro de calcio = CaCl2
Masa atómica del Ca = 40,078 uma
Masa atómica del Cl = 35,453 uma
Al ser un compuesto iónico no tiene peso molecular, sino peso fórmula..
Peso fórmula del CaCl2 = (40,078) + 2(35,453) = 110,984 uma
De manera que, un mol de CaCl2 tendrá una masa de 110,984 gramos. Y entonces, 1,5 moles de CaCl2 pesarán:
(1,5 mol)(110,984 gramos/mol) = 166,476 gramos
Ejemplo: Si tuviera 2,8 gramos de oro, ¿cuántos átomos de oro tendría?
Fórmula del oro: Au
Peso fórmula del Au = 196,9665 uma
Por lo tanto, 1 mol de oro pesa 196,9665 gramos.
De manera que, en 2,8 gramos de oro habrá:
(2,8 gramos)(1 mol/196,9665 gramos) = 0,0142 mol
Por lo cual, en 0,0142 moles tendremos:
(0,0142 moles)(6,02x1023atomos/moles)=8,56x1021 átomos
9.7. Fórmula empírica a partir del análisis elemental
Una fórmula empírica nos indica las proporciones relativas de los diferentes átomos de un compuesto.
Estas proporciones son ciertas también a nivel molar.
Entonces, el H2O tiene dos átomos de hidrógeno y un átomo de oxígeno.
De la misma manera, 1,0 mol de H2O está compuesta de 2,0 moles de átomos de hidrógeno y 1,0 mol de átomos de oxígeno.
También podemos trabajar a la inversa a partir de las proporciones molares:
Si conocemos las cantidades molares de cada elemento en un compuesto, podemos determinar la fórmula empírica.
El mercurio forma un compuesto con el cloro que tiene 73,9% de mercurio y 26,1% de cloro en masa. ¿Cuál es su fórmula empírica?.
Supongamos que tenemos una muestra de 100 gramos de este compuesto. Entonces la muestra tendrá 73,9 gramos de mercurio y 26,1 gramos decloro.
¿Cuántas moles de cada átomo representan las masas individuales?
Para el mercurio: (73,9 g) x (1 mol/200,59 g) = 0,368 moles
Para el cloro: (26,1 g) x (1 mol/35,45 g) = 0,736 mol
¿Cuál es la proporción molar de los dos elementos?
( 0,736 mol Cl/0,368 mol Hg) = 2,0
9.8. Fórmula molecular a partir de la fórmula empírica
La fórmula química de un compuesto obtenida por medio del análisis de sus elementos o de su composición siempre será la fórmula empírica.
Para poder obtener la fórmula molecular necesitamos conocer el peso molecular del compuesto.
La fórmula química siempre será algún múltiplo entero de la fórmula empírica (es decir, múltiplos enteros de los subíndices de la fórmula empírica).
La Vitamina C (ácido ascórbico) tiene 40,92 % de C y 4,58 % de H, en masa.
El resto, hasta completar el 100%, es decir el 54,50 %, es de O.
El peso molecular de este compuesto es de 176 uma. ¿Cuáles serán su fórmula molecular o química y su fórmula empírica?
En 100 gramos de ácido ascórbico tendremos:
- 40,92 gramos C
- 4,58 gramos H
- 54,50 gramos O
(40,92 g de C) x (1 mol/12,011 g) = 3,407 moles de C
(4,58 g de H) x (1 mol/1,008 g) = 4,544 moles de H
(54,50 g de O) x (1 mol/15,999 g) = 3,406 moles de O
Para determinar la proporción simplemente dividimos entre la cantidad molar más pequeña (en este caso 3,406 o sea la del oxígeno):
- C = 3,407 moles/3,406 moles = 1,0
- H = 4,544 moles/3,406 moles = 1,333
- O = 3,406 moles/3,406 moles = 1,0
1,333 es como 1 y 1/3, así que si multiplicamos las proporciones de cada átomo por 3 obtendremos valores enteros para todos los átomos.
- C = 1,0 x 3 = 3
- H = 1,333 x 3 = 4
- O = 1,0 x 3 = 3
Esta es la fórmula empírica para el ácido ascórbico. Pero, ¿y la fórmula molecular?
Nos dicen que el peso molecular de este compuesto es de 176 uma.
¿Cuál es el peso molecular de nuestra fórmula empírica?
(3 x 12,011) + (4 x 1,008) + (3 x 15,999) = 88,062 uma
El peso molecular de nuestra fórmula empírica es significativamente menor que el valor experimental.
¿Cuál será la proporción entre los dos valores?
(176 uma / 88,062 uma) = 2,0
Parece que la fórmula empírica pesa esencialmente la mitad que la molecular.
Si multiplicamos la fórmula empírica por dos, entonces la masa molecular será la correcta.
Entonces, la fórmula molecular será:
2 x C3H4O3 = C6H8O6
10. DISOLUCIONES
Disolución. Mezcla homogénea de 2 ó más componentes, siendo el disolvente el que está en mayor proporción y el/los soluto/s los que están en menor proporción.
Disolución. Mezcla homogénea de 2 ó más componentes, siendo el disolvente el que está en mayor proporción y el/los soluto/s los que están en menor proporción.
Algunas formas de expresar la concentración son:
Los gases ideales cumplen la hipótesis de Avogadro que establece que "una cantidad de cualquier tipo de gas, en un mismo volumen, a la misma temperatura y la misma presión, contiene el mismo número de moléculas, independientemente del tipo de gas que sea".
En condiciones normales (0ºC y 1 atm), 1 mol de gas ideal (que contiene NA moléculas), ocupa 22,4 litros, independientemente del tipo de gas que haya dentro del recipiente.
El volumen de un gas ideal en unas determinadas condiciones de presión y temperatura, se calcula a través de la ecuación general de los gases ideales.
Concentración en masa / volumen
|
Concentración en tanto por ciento en masa
|
Concentración en tanto por ciento en volumen
|
En el ámbito de la química expresamos la concentración también de tres maneras diferentes: Molaridad (la más frecuente), Molalidad (se usa en propiedades coligativas como el aumento ebulloscópico o el descenso crioscópico) y Fracción molar (se usa en la Ley de Raoult y en el cálculo de las presiones parciales).
Molaridad
En condiciones normales (0ºC y 1 atm), 1 mol de gas ideal (que contiene NA moléculas), ocupa 22,4 litros, independientemente del tipo de gas que haya dentro del recipiente.
El volumen de un gas ideal en unas determinadas condiciones de presión y temperatura, se calcula a través de la ecuación general de los gases ideales.

11.2. Conservación de la masa
Si tuviéramos que decidir cuál es la ley o principio más importante en el campo de la Química no cabría ninguna duda, el principio de consevación de la masa o ley de Lavoisier. Y no por su complejidad, que no tiene ninguna, sino porque su establecimiento, a finales del siglo XVIII, marcó el nacimiento de la química moderna y el abandono de su predecesora, la alquimia. y por ello a su autor, el francés Antoine-Laurent Lavoisier ( 1743-1794) se le conoce como el padre de la química.
Se puede enunciar de distintas formas:
La materia ni se crea ni se destruye, sólo se transforma.
En una reacción química la suma de la masa de los reactivos es igual a la suma de la masa de los productos.
En una reacción química los átomos no desaparecen, simplemente se ordenan de otra manera.
Aunque te pueda parecer muy lógica y sensata esta idea, y que no tiene mucho mérito haber llegado a esa conclusión, Lavoisier tuvo que realizar numerosos y meticulosos experimentos para convencer a los que por entonces pensaban que al calentar un metal este ganaba masa cuando se convertía en una nueva sustancia. Lavoisier midió en un recipiente cerrado las masas del sólido y el aire antes y después de la combustión y llegó a la conclusión de quela masa que ganaba el metal era igual a la masa de aire que se perdía.

Relaciones molares
Sabemos que hay una relación directa entre mol y molécula. Esta relación es el número de Avogadro. Un mol siempre contiene el número de Avogadro de moléculas. Por tanto las relaciones existentes entre moléculas dadas por los coeficientes estequiométricos también son válidas para los moles.
Los coeficientes estequiométricos indican la proporción en la que intervienen los moles de reactivos y productos en una reacción química.
ANIMACIONES





11.3. Ley de las proporciones o ley de Proust
11.3.1. Ley de las proporciones múltiples (o de Dalton).
Las cantidades de un mismo elemento que se unen con una cantidad fija de otro elemento para formar en cada caso un compuesto distinto están en la relación de números enteros sencillos.
La ley de Proust no impide que dos o más elementos se unan en varias proporciones para formar varios compuestos. Así, por ejemplo, el oxígeno y el cobre se unen en dos proporciones y forman dos óxidos de cobre que contienen 79,90 % y 88,83 % de cobre. Si calculamos la cantidad de cobre combinado con un mismo peso de oxígeno, tal como 1g, se obtiene en cada caso:


Las dos cantidades de cobre son, muy aproximadamente, una doble de la otra y, por tanto, los pesos de cobre que se unen con un mismo peso de oxígeno para formar los dos óxidos están en la relación de 1 es a 2.
El enunciado de la ley de las proporciones múltiples se debe a DALTON, en 1803 como resultado de su teoría atómica y es establecida y comprobada definitivamente para un gran número de compuestos por BERZELIUS en sus meticulosos estudios de análisis de los mismos.



GAY-LUSSAC formuló en 1808 la ley de los volúmenes de combinación que lleva su nombre. Al obtener vapor de agua a partir de los elementos (sustancias elementales) se había encontrado que un volumen de oxígeno se une con dos volúmenes de hidrógeno formándose dos volúmenes de vapor de agua; todos los volúmenes gaseosos medidos en las mismas condiciones de presión y temperatura.

Esta relación sencilla entre los volúmenes de estos cuerpos gaseosos reaccionantes no era un caso fortuito pues GAY-LUSSAC mostró que se cumplía en todas las reacciones en que intervienen gases tal como muestran los esquemas siguientes:



GAY-LUSSAC observó que el volumen de la combinación gaseosa resultante era inferior o a lo más igual a la suma de los volúmenes de las substancias gaseosas que se combinan.
La ley no se aplica a la relación entre los volúmenes de los cuerpos sólidos y líquidos reaccionantes tal como el volumen de azufre que se une con el oxígeno para formar anhídrido sulfuroso.
ANIMACIONES
13. LEY DE HESS
La velocidad de una reacción no está relacionada directamente con su energía de reacción. Una reacción puede ser rápida y ser exotérmica o endotérmica y viceversa.
La energía de reacción se obtiene de restar la energía de los enlaces que se rompen a la energía de los enlaces que se forman.
La velocidad está relacionada con la facilidad o dificultad para romper los enlaces.
Ambos factores no están directamente relacionados, por lo que no se puede establecer relación entre energía y velocidad.
Cuando se produce una reacción química, los enlaces que unen los átomos deben romperse y formarse otros nuevos. Las moléculas se rompen y se forman moléculas nuevas, diferentes de las que había anteriormente.
Para poder romper los enlaces existentes, es necesario suministrar una energía, la energía de activación, que permite que la transformación química comience.
Si los productos de la reacción tienen menos energía que los reactivos, variación de energía < 0, la propia reacción producirá energía y continuará por sí sola: es una reacción exotérmica. Pero para iniciarla seguirá siendo necesario suministrar la energía de activación. Así, para encender una cerilla, basta frotarla con el rascador. Una vez iniciada la combustión, ésta continuará, pero se necesita frotar para que la cerilla encienda.
Si los productos tienen más energía que los reactivos, variación de energía > 0, la reacción no produce energía, sino que la consume y es necesario suministrar energía constantemente para que la reacción tenga lugar, en caso contrario, se detiene: es una reacción endotérmica. Por eso, al cocinar, se debe mantener los alimentos sobre el fuego, en el momento en que dejan de calentarse, la reacción se detiene y los alimentos quedan crudos.

CH4 + 2 O2 --------------------------- CO2 + 2 H2O + 875 kJ (Proceso exotérmico)
Los coeficientes estequiométricos indican la proporción en la que intervienen los moles de reactivos y productos en una reacción química.





11.3. Ley de las proporciones o ley de Proust
Cuando dos o más elementos se combinan para formar un determinado compuesto lo hacen en una relación en peso constante independientemente del proceso seguido para formarlo.
Esta ley también se puede enunciar desde otro punto de vista
Para cualquier muestra pura de un determinado compuesto los elementos que lo conforman mantienen una proporción fija en peso, es decir, una proporción ponderal constante.
Así, por ejemplo, en el agua los gramos de hidrógeno y los gramos de oxígeno están siempre en la proporción 1/8, independientemente del origen del agua.
Estos delicados análisis fueron realizados sobre todo por el químico sueco BERZELIUS (1779 - 1848). No obstante, será el francés PROUST, en 1801, quien generalice el resultado enunciando la ley a la que da nombre.
La ley de las proporciones definidas no fue inmediatamente aceptada al ser combatida por BERTHOLLET, el cual, al establecer que algunas reacciones químicas son limitadas, defendió la idea de que la composición de los compuestos era variable. Después, de numerosos experimentos pudo reconocerse en 1807 la exactitud de la ley de Proust.



11.3.1. Ley de las proporciones múltiples (o de Dalton).
Las cantidades de un mismo elemento que se unen con una cantidad fija de otro elemento para formar en cada caso un compuesto distinto están en la relación de números enteros sencillos.
La ley de Proust no impide que dos o más elementos se unan en varias proporciones para formar varios compuestos. Así, por ejemplo, el oxígeno y el cobre se unen en dos proporciones y forman dos óxidos de cobre que contienen 79,90 % y 88,83 % de cobre. Si calculamos la cantidad de cobre combinado con un mismo peso de oxígeno, tal como 1g, se obtiene en cada caso:
Las dos cantidades de cobre son, muy aproximadamente, una doble de la otra y, por tanto, los pesos de cobre que se unen con un mismo peso de oxígeno para formar los dos óxidos están en la relación de 1 es a 2.
El enunciado de la ley de las proporciones múltiples se debe a DALTON, en 1803 como resultado de su teoría atómica y es establecida y comprobada definitivamente para un gran número de compuestos por BERZELIUS en sus meticulosos estudios de análisis de los mismos.
11.3.2. Ley de las proporciones recíprocas (0 de Richter).
Los pesos de diferentes elementos que se combinan con un mismo peso de un elemento dado, dan la relación de pesos de estos Elementos cuando se combinan entre sí o bien múltiplos o submúltiplos de estos pesos.
Así, por ejemplo, con 1g de oxígeno se unen: 0,1260 g de hidrógeno, para formar agua; 4,4321 g de cloro, para formar anhídrido hipocloroso; 0,3753 g de carbono para formar gas carbónico, 1,0021 g de azufre, para formar gas sulfuroso, y 2,5050 g de calcio, para formar óxido cálcico. Pero los elementos hidrógeno, cloro, carbono, azufre y calcio pueden a su vez combinarse mutuamente y cuando lo hacen se encuentra, sorprendentemente, que estas cantidades, multiplicadas en algún caso por números enteros sencillos, son las que se unen entre sí para formar los correspondientes compuestos
Esta ley llamada también de las proporciones equivalentes fue esbozada por RICHTER en 1792 y completada varios años más tarde por WENZEL.
La ley de las proporciones recíprocas conduce a fijar a cada elemento un peso relativo de combinación, que es el peso del mismo que se une con un peso determinado del elemento que se toma como tipo de referencia.
Al ser el oxígeno el elemento que se combina con casi todos los demás se tomó inicialmente como tipo 100 partes en peso de oxígeno; la cantidad en peso de cada elemento que se combinaba con estas 100 partes en peso de oxígeno era su peso de combinación. El menor peso de combinación que así se encontraba era el del hidrógeno, por lo que fue natural tomar como base relativa de los pesos de combinación de los elementos el valor 1 para el hidrógeno; en esta escala el oxígeno tiene el valor 7,9365 (según las investigaciones últimamente realizadas) y otros elementos tienen también valores algo inferiores a números enteros. Pero puesto que el hidrógeno se combina con muy pocos elementos y el peso de combinación de éstos tenía que encontrarse en general a partir de su combinación con el oxígeno, se decidió finalmente tomar nuevamente el oxígeno como base de los pesos de combinación redondeando su peso tipo a 8,000; el del hidrógeno resulta ser igual a 1,008 y el de varios elementos son ahora números aproximadamente enteros.
Estos pesos de combinación se conocen hoy como pesos equivalentes. El peso equivalente de un elemento (o compuesto) es la cantidad del mismo que se combina o reemplaza -equivale químicamente- a 8,000 partes de oxígeno o 1,008 partes de hidrógeno. Se denomina también equivalente químico.
Debido a la ley de las proporciones múltiples algunos elementos tienen varios equivalentes.


ANIMACIONES
11.4. Ley de los volúmenes de combinación (de Gay-Lussac)
Muchos de los elementos y compuestos son gaseosos, y puesto que es más sencillo medir un volumen que un peso de gas era natural se estudiasen las relaciones de volumen en que los gases se combinan.
En cualquier reacción química los volúmenes de todas las substancias gaseosas que intervienen en la misma, medidos en las mismas condiciones de presión y temperatura, están en una relación de números enteros sencillos.
Los pesos de diferentes elementos que se combinan con un mismo peso de un elemento dado, dan la relación de pesos de estos Elementos cuando se combinan entre sí o bien múltiplos o submúltiplos de estos pesos.
Así, por ejemplo, con 1g de oxígeno se unen: 0,1260 g de hidrógeno, para formar agua; 4,4321 g de cloro, para formar anhídrido hipocloroso; 0,3753 g de carbono para formar gas carbónico, 1,0021 g de azufre, para formar gas sulfuroso, y 2,5050 g de calcio, para formar óxido cálcico. Pero los elementos hidrógeno, cloro, carbono, azufre y calcio pueden a su vez combinarse mutuamente y cuando lo hacen se encuentra, sorprendentemente, que estas cantidades, multiplicadas en algún caso por números enteros sencillos, son las que se unen entre sí para formar los correspondientes compuestos
Esta ley llamada también de las proporciones equivalentes fue esbozada por RICHTER en 1792 y completada varios años más tarde por WENZEL.
La ley de las proporciones recíprocas conduce a fijar a cada elemento un peso relativo de combinación, que es el peso del mismo que se une con un peso determinado del elemento que se toma como tipo de referencia.
Al ser el oxígeno el elemento que se combina con casi todos los demás se tomó inicialmente como tipo 100 partes en peso de oxígeno; la cantidad en peso de cada elemento que se combinaba con estas 100 partes en peso de oxígeno era su peso de combinación. El menor peso de combinación que así se encontraba era el del hidrógeno, por lo que fue natural tomar como base relativa de los pesos de combinación de los elementos el valor 1 para el hidrógeno; en esta escala el oxígeno tiene el valor 7,9365 (según las investigaciones últimamente realizadas) y otros elementos tienen también valores algo inferiores a números enteros. Pero puesto que el hidrógeno se combina con muy pocos elementos y el peso de combinación de éstos tenía que encontrarse en general a partir de su combinación con el oxígeno, se decidió finalmente tomar nuevamente el oxígeno como base de los pesos de combinación redondeando su peso tipo a 8,000; el del hidrógeno resulta ser igual a 1,008 y el de varios elementos son ahora números aproximadamente enteros.
Estos pesos de combinación se conocen hoy como pesos equivalentes. El peso equivalente de un elemento (o compuesto) es la cantidad del mismo que se combina o reemplaza -equivale químicamente- a 8,000 partes de oxígeno o 1,008 partes de hidrógeno. Se denomina también equivalente químico.
Debido a la ley de las proporciones múltiples algunos elementos tienen varios equivalentes.


ANIMACIONES
11.4. Ley de los volúmenes de combinación (de Gay-Lussac)
Muchos de los elementos y compuestos son gaseosos, y puesto que es más sencillo medir un volumen que un peso de gas era natural se estudiasen las relaciones de volumen en que los gases se combinan.
En cualquier reacción química los volúmenes de todas las substancias gaseosas que intervienen en la misma, medidos en las mismas condiciones de presión y temperatura, están en una relación de números enteros sencillos.
GAY-LUSSAC formuló en 1808 la ley de los volúmenes de combinación que lleva su nombre. Al obtener vapor de agua a partir de los elementos (sustancias elementales) se había encontrado que un volumen de oxígeno se une con dos volúmenes de hidrógeno formándose dos volúmenes de vapor de agua; todos los volúmenes gaseosos medidos en las mismas condiciones de presión y temperatura.
Esta relación sencilla entre los volúmenes de estos cuerpos gaseosos reaccionantes no era un caso fortuito pues GAY-LUSSAC mostró que se cumplía en todas las reacciones en que intervienen gases tal como muestran los esquemas siguientes:
GAY-LUSSAC observó que el volumen de la combinación gaseosa resultante era inferior o a lo más igual a la suma de los volúmenes de las substancias gaseosas que se combinan.
La ley no se aplica a la relación entre los volúmenes de los cuerpos sólidos y líquidos reaccionantes tal como el volumen de azufre que se une con el oxígeno para formar anhídrido sulfuroso.
12. PRIMER PRINCIPIO DE LA TERMODINÁMICA
Energía Interna (U):
Un sistema termodinámico posee una cierta energía que llamamos energía interna (U), debida a la propia constitución de la materia (enlaces de la moléculas, interacciones entre ellas, choques térmicos....).
Trabajo (W):
Un medio para transferir energía de un sistema a otro es el trabajo; que se considera positivo si lo que produce es una compresión, y negativo en una expansión. dW= - P dV
Calor (Q):
El calor representa la cantidad de energía que un cuerpo transfiere a otro como consecuencia de una diferencia de temperatura.
Primer Principio de la Termodinámica:
“La variación de la energía interna de un sistema es igual a la suma entre el calor transferido y el trabajo realizado".
La energía interna es una función de estado  ; y como tal su variación solo depende del estado inicial y del estado final y no de la trayectoria o camino seguido para realizarlo.
; y como tal su variación solo depende del estado inicial y del estado final y no de la trayectoria o camino seguido para realizarlo.
La energía interna de un sistema es una función de estado, pero el calor y el trabajo no lo son. El calor y el trabajo desarrollados en un proceso son función de la trayectoria que siga el proceso. Calor y trabajo no son propiedades del sistema, son solo formas de modificar la energía del mismo.
12.1. Entalpía (H):
Como la mayor parte de los procesos transcurren a presión constante (la atmosférica), es útil definir una nueva función de estado, que represente el calor intercambiado en esas circunstancias (Qp). Esta función se llamaentalpía (H). La relación entre su variación y la variación de energía interna ofrece expresiones muy interesantes, que siempre tienen presente el primer principio de la termodinámica:
“Cuando una reacción puede expresarse como la suma algebraica de dos o más reacciones, su calor de reacción es igual a la suma algebraica de los calores de reacción de las reacciones parciales”
Ejemplo:
14. MÍNIMA ENERGÍA Y MÁXIMO DESOREDEN (2º PRINCIPIO DE LA TERMODINÁMICA)
14.1. El principio de mínima energía
Como en toda la naturaleza, también en las reacciones químicas opera el principio de mínima energía según el cual los sistemas materiales tienden a evolucionar en el sentido en el que disminuye su energía potencial.
Una bola rueda por un plano inclinado hasta encontrar la posición más baja, que es la de menor energía; un muelle comprimido se expande para conseguir una condición de mínima deformación y, por tanto, de mínima energía acumulada, y una reacción química evoluciona hacia estados de menor contenido energético.
Sucede, en ocasiones, que siendo el contenido energético de los productos inferior al de los reactivos, el sistema en cuestión no evoluciona espontáneamente como cabría esperar según el principio de mínima energía.
En una parte de los casos, esto es debido a que se precisa una cierta cantidad de energía, por lo general pequeña, para poner en marcha la reacción, de la misma manera que es preciso dar un impulso inicial a un bloque de madera para que descienda por un plano inclinado.
Esta dosis de energía inicial se denomina energía de activación y se emplea en la ruptura de los primeros enlaces, que suministrará energía propia suficiente como para mantener la reacción por sí misma.
14.2. El principio de máximo desorden
De acuerdo con el principio de mínima energía, considerado aisladamente, ninguna reacción endotérmica podría ser espontánea, pues en este tipo de reacciones la energía del sistema aumenta.
Sin embargo, existen en la naturaleza reacciones y procesos que, siendo endotérmicos, se producen espontáneamente. Ello indica que, junto con la energía, otro factor debe condicionar el carácter espontáneo de una reacción química. Ese factor adicional es el grado de desorden, también denominado entropía (S).
La entropía es una magnitud que da idea del grado de desorden molecular de un sistema. El paso de hielo a agua líquida y de ésta a vapor de agua aumenta el valor de la entropía del sistema.
La entropía depende de factores tales como el número de partículas en juego o el estado físico de las sustancias. Así el estado gaseoso es más desordenado que el líquido o que el sólido y corresponde, por lo tanto, a una mayor entropía.
Junto con la tendencia a alcanzar el estado de mínima energía, los sistemas químicos tienden de forma natural a alcanzar el estado de máximo desorden y son ambos factores los que controlan conjuntamente el carácter espontáneo de las reacciones químicas.
14.3. Espontaneidad. La función de Gibbs

Ni la entalpía (H) ni la entropía (S) nos dicen directamente si un proceso es espontáneo o no lo es. La función de Gibbs, (o energía libre), sí que nos da la medida de la espontaneidad del proceso. La función de Gibbs es una función de estado, es decir, sólo depende del estado final e inicial del sistema y no del camino seguido para pasar de uno a otro, y se define como:
 La función de Gibbs también tiene unidades de energía y como en casos anteriores, no podemos determinar su valor absoluto y nos tenemos que conformar con calcular sus variaciones. En un proceso determinado a presión y temperatura constantes (condiciones habituales de trabajo en química), se cumplirá que:
La función de Gibbs también tiene unidades de energía y como en casos anteriores, no podemos determinar su valor absoluto y nos tenemos que conformar con calcular sus variaciones. En un proceso determinado a presión y temperatura constantes (condiciones habituales de trabajo en química), se cumplirá que:
Vamos a estudiar las distintas posibilidades de DG:

- Si DG < 0
proceso espontáneo.
- Si DG = 0
alcanza el equilibrio.
- Si DG > 0
proceso no espontáneo; espontáneo el inverso.
Un proceso es espontáneo, no espontáneo o está en equilibrio si:
15. RELACIÓN ENTRE LA ENERGÍA Y LA VELOCIDAD DE REACCIÓN
La velocidad de una reacción no está relacionada directamente con su energía de reacción. Una reacción puede ser rápida y ser exotérmica o endotérmica y viceversa.
La energía de reacción se obtiene de restar la energía de los enlaces que se rompen a la energía de los enlaces que se forman.
La velocidad está relacionada con la facilidad o dificultad para romper los enlaces.
Ambos factores no están directamente relacionados, por lo que no se puede establecer relación entre energía y velocidad.
Cuando se produce una reacción química, los enlaces que unen los átomos deben romperse y formarse otros nuevos. Las moléculas se rompen y se forman moléculas nuevas, diferentes de las que había anteriormente.
Para poder romper los enlaces existentes, es necesario suministrar una energía, la energía de activación, que permite que la transformación química comience.
Si los productos de la reacción tienen menos energía que los reactivos, variación de energía < 0, la propia reacción producirá energía y continuará por sí sola: es una reacción exotérmica. Pero para iniciarla seguirá siendo necesario suministrar la energía de activación. Así, para encender una cerilla, basta frotarla con el rascador. Una vez iniciada la combustión, ésta continuará, pero se necesita frotar para que la cerilla encienda.
Si los productos tienen más energía que los reactivos, variación de energía > 0, la reacción no produce energía, sino que la consume y es necesario suministrar energía constantemente para que la reacción tenga lugar, en caso contrario, se detiene: es una reacción endotérmica. Por eso, al cocinar, se debe mantener los alimentos sobre el fuego, en el momento en que dejan de calentarse, la reacción se detiene y los alimentos quedan crudos.
El calor absorbido o desprendido puede añadirse a la ecuación química como un elemento más del proceso:
CH4 + 2 O2 --------------------------- CO2 + 2 H2O + 875 kJ (Proceso exotérmico)
2 KClO3 + 89,4 (kJ) ---------------------------- 2 KCl + 3 O2 (Proceso endotérmico)
15.1. Velocidad de reacción.
Es una medida relacionada con el tiempo que tardan los reactivos en transformarse en productos.
La velocidad de una reacción química depende fundamentalmente de los siguientes factores:
15.2. Presencia de catalizadores
Un catalizador es una sustancia, distinta a los reactivos o los productos, que modifican la velocidad de una reacción. Al final de la misma, el catalizador se recupera por completo e inalterado. En general, hace falta muy poca cantidad de catalizador.
Los catalizadores aumentan la velocidad de la reacción, pero no la cantidad de producto que se forma.
Es una medida relacionada con el tiempo que tardan los reactivos en transformarse en productos.
La velocidad de una reacción química depende fundamentalmente de los siguientes factores:
- Naturaleza de los reactivos. Cuanta más afinidad tengan entre ellos mayor será la velocidad de reacción.
- Temperatura. En general, la velocidad de una reacción química aumenta conforme se eleva la temperatura.
- Grado de división de los reactivos. Cuanto más divididos están los reactivos, más rápida es la reacción. Esto es así porque se aumenta la superficie expuesta a la misma.
- Presencia de catalizadores. Aceleran la velocidad de reacción disminuyendo la enrgía de activación.
- Presencia de inhibidores. Disminuye la velocidad de reacción
- La concentración de los reactivos. Para aumentar la concentración de un reactivo:
- Si es un gas, se consigue elevando su presión.
- Si se encuentra en disolución, se consigue cambiando la relación entre el soluto y el disolvente.
- Superficie de contacto de los reactivos
15.2. Presencia de catalizadores
Un catalizador es una sustancia, distinta a los reactivos o los productos, que modifican la velocidad de una reacción. Al final de la misma, el catalizador se recupera por completo e inalterado. En general, hace falta muy poca cantidad de catalizador.
Los catalizadores aumentan la velocidad de la reacción, pero no la cantidad de producto que se forma.
16. MECANISMOS DE REACCIÓN
Hemos comentado que en las reacciones químicas se producen procesos de ruptura y formación de enlaces químicos.
La descripción detallada de todo el proceso, que a nivel atómico se produce durante una reacción química, se conoce con el nombre de mecanismo de reacción.
Por tanto, el mecanismo de una reacción no es más que explicar con el mayor detalle posible como se producen los cambios de los reactivos para llegar a los productos. Esto implica indicar la posición de los átomos y la formación y ruptura de los enlaces a lo largo del proceso de reacción.
Los mecanismos se clasifican en dos grandes grupos:
- Mecanismos elementales o concertados: son aquellos en los que los reactivos se convierten directamente en productos sin que se forme entremedio ninguna otra especie química.
- Mecanismos por etapas o complejas: en este caso los reactivos no se transforma directamente en productos sino que se transforman en "intermedios de reacción" que a su vez se transforman en los productos.
16.1. Teoría de colisiones
Según esta teoría para que se produzca una reacción deben cumplirse tres condiciones:



17. NOTACIÓN DE LAS REACCIONES
Los cambios químicos se representan o escriben mediante lo que denominamos como ecuación química.
En una ecuación química los reactivos se escriben a la izquierda y los productos a la derecha y en medio una flecha.
Según esta teoría para que se produzca una reacción deben cumplirse tres condiciones:
- Las moléculas de los reactivos tienen que chocar entre sí.
- Estos choques deben de producirse con energía suficiente de forma que se puedan romper y formar enlaces químicos.
- En el choque debe haber una orientación adecuada para que los enlaces que se tienen que romper y formar estén a una distancia y posición viable.
- A continuación se ponen dos ejemplos esquemáticos de como podrían ser según la teoría de colisiones dos reacciones químicas.

17. NOTACIÓN DE LAS REACCIONES
Los cambios químicos se representan o escriben mediante lo que denominamos como ecuación química.
En una ecuación química los reactivos se escriben a la izquierda y los productos a la derecha y en medio una flecha.
Hemos comentado que en las reacciones químicas los reactivos desaparecen y se convierten en productos. También puede pasar que los productos se conviertan de nuevo en los reactivos. Por tanto se producen dos procesos químicos simultáneamente, uno en el que los reactivos se convierten en productos y otro en sentido contrario en el que los productos se convierten en reactivos. Cuando esto sucede se dice que estamos en una situación de equilibrio químico.
17.1 Justificación del ajuste químico
Dado que los átomos se conservan en las reacciones químicas, debe haber el mismo número y tipo de átomos en los reactivos y en los productos.
Ajustar una reacción consiste en colocar unos "números" delante de cada una de las fórmulas de los reactivos y productos, llamados coeficientes estequiométricos, que multiplican el valor del número de átomos del compuesto al que precede.
Dicho con otras palabras, el coeficiente estequiométrico de un compuesto indica cuantas veces está presente ese compuesto en la reacción química.
Existen fundamentalmente dos métodos de ajustes de reacciones: el método de tanteo y el de los coeficientes indeterminados.
La siguiente reacción está sin ajustar, en la zona de los reactivos tenemos cuatro átomos de C y en los productos solo uno:
Para ajustarla tenemos que buscar los coeficientes que logran que el número de átomos de cada elemento sea igual en los reactivos que en los productos:
2 CO(g) + O2(g) --------- 2 CO2(g)
2 HgO(s) ---------------- 2 Hg(l) + O2(g)
2 HCl(ac) + Zn(s) -------------- ZnCl2(ac) + H2(g)
17.1.1. Método de ajuste por tanteo
Este método consiste en probar con diferentes valores para los coeficientes estequiométricos hasta que se cumpla que haya el mismo número de átomos de cada tipo en productos y reactivos.
Una reacción puede estar ajustada para diferentes valores de los coeficientes estequiométricos. Los coeficientes también pueden tener valores fraccionarios.
Normalmente se ajustan las reacciones dando el menor valor posible a los coeficientes, evitando los coeficientes fraccionarios.
17.1.2. Método de los coeficientes indeterminados
En este método seguimos estos pasos:
1. Cada uno de los coeficientes se considera una incógnita que se representa con una letra.
2. Se construye una ecuación para cada elemento químico, con ello s e construye un sistema de ecuaciones que tendrá tantas ecuaciones como elementos químicos diferentes tenga la reacción química.
3. Se asigna un valor arbitrario (el que se quiera) a cualquiera de los coeficientes. Normalmente se procura que sea uno sencillo.
4. Se resuelve el sistema de ecuaciones, y se coloca en la reacción química el valor de los coeficientes calculados. Si se desea se puede simplificar el resultado dividiendo todos los coeficientes por un mismo valor.
Existen varios métodos para ajustar ecuaciones químicas. Se empleará el de los coeficientes variables. Para ello, se asigna una incógnita a cada una de las fórmulas que aparecen en la ecuación química. Por ejemplo, en la reacción entre el trioxocarbonato(IV) de sodio y el cloruro de hidrógeno, que produce cloruro de sodio, agua y dióxido de carbono:
En este método seguimos estos pasos:
1. Cada uno de los coeficientes se considera una incógnita que se representa con una letra.
2. Se construye una ecuación para cada elemento químico, con ello s e construye un sistema de ecuaciones que tendrá tantas ecuaciones como elementos químicos diferentes tenga la reacción química.
3. Se asigna un valor arbitrario (el que se quiera) a cualquiera de los coeficientes. Normalmente se procura que sea uno sencillo.
4. Se resuelve el sistema de ecuaciones, y se coloca en la reacción química el valor de los coeficientes calculados. Si se desea se puede simplificar el resultado dividiendo todos los coeficientes por un mismo valor.
Existen varios métodos para ajustar ecuaciones químicas. Se empleará el de los coeficientes variables. Para ello, se asigna una incógnita a cada una de las fórmulas que aparecen en la ecuación química. Por ejemplo, en la reacción entre el trioxocarbonato(IV) de sodio y el cloruro de hidrógeno, que produce cloruro de sodio, agua y dióxido de carbono:
a Na2CO3 + b HCl  c NaCl + d CO2 + e H2O
c NaCl + d CO2 + e H2O
Na a · 2 = c · 1
C a · 1 = d · 1
O a · 3 = d · 2 + e · 1
H b · 1 = e · 2
Cl b · 1 = c · 1
Para cada elemento se establece una ecuación, que iguala los átomo de ese elemento en los reactivos y en los productos:
Aparece un sistema indeterminado que hay que resolver. Se resuelve por tanteo, asignando, a una de las incógnitas, un valor.
Si se hace que b = 2, resulta e = 1, c = 2, a = 1 y d = 1. La ecuación es:
Na2CO3 + 2·HCl  2·NaCl + CO2 + H2O
2·NaCl + CO2 + H2O
- Toda reacción química debe estar ajustada.
- Las relaciones molares en una reacción química vienen dados por los coeficientes estequiométricos.
- El número de moléculas está relacionado con el número de moles mediante el número de Avogadro.
- El número de moles y la masa de las sustancias están relacionados mediante la masa molar.
- En el caso de gases ideales, el volumen de estos se relacionan con los moles a través de la ecuación general de los gases ideales.
1. Ajusta las siguientes ecuaciones químicas, usando el applet e indica el tipo de reacción de cada una:
a) C8H18 + O2 --------- CO2 + H2O
b) CaCO3 + HCl ------ CaCl2 + CO2 + H2O
c) Zn + H2SO4 -------- ZnSO4 + H2
d) NaCl + MnO2 + H2SO4 ---------- MnSO4 + Na2SO4 + Cl2 + H2O
e) PbS + H2O2 -------- PbSO4 + H2O
f) HCl + K2Cr2O7 --- Cl2 + CrCl3 + KCl + H2O
g) NH3 + O2 ----------- NO + H2O
h) Sn + HNO3 --------- SnO2 + NO2 + H2O
i) HI + HNO3 ------------ NO + H2O + I2
j) KMnO4 + HCl ----- MnCl2 + KCl + Cl2 + H2O
2. Indica si las ecuaciones químicas siguientes corresponden a reacciones de síntesis, de descomposición o desplazamiento y ajústalas:
a) HCl (ac) + Al(OH)3 (s) --------- AlCl3 (ac) + H2O (l)
b) Fe (s) + CuSO4 (ac) -------------- Cu (s) + FeSO4 (ac)
c) HgO (s) ----------------------------- Hg (s) + O2 (g)
d) SO2 (g) + O2 (g) ------------------- SO3 (g)
e) H2S (ac) + O2 (g) ------------------ S (s) + H2O (l)
f) NH3 (g)+ Mg (s) ------------------- Mg3N2 (s)+ H2 (g)
3. Completa y ajusta mediante el applet las siguientes ecuaciones químicas:
a) CaO + H2O ---------------- ...........
b) Zn + HCl ------------------- ......... + .........
c) Al + H2SO4 ---------------- ........ + .........
d) C5H10 + O2 --------------- ......... + .........
e) Ca(OH)2 + HCl ----------- ....... + .........
f) Mg(OH)2 + HNO3 ------- ........ + .......
g) H2SO4 + Ba(OH)2 ------ ......... + .........
h) Ag2O ----------------------- ........ + ........
i) ZnO + C -------------------- ....... + ......
j) CH3COOH + CH3CH2CH2OH -------------- ............................... + .........
ANIMACIONES















Con desprendimiento de gases.
Con precipitados.
Con cambios de temperatura.
Con cambios de color.
Ajuste de reacciones 1, 2, 3, 4, 5, 6 y 7
Cuando se ha ajustado una ecuación, los coeficientes representan el número de átomos de cada elemento en los reactivos y en los productos. También representan el número de moléculas y de moles de reactivos y productos.
Cuando una ecuación está ajustada, la estequiometría se emplea para saber las moles de un producto obtenidas a partir de un número conocido de moles de un reactivo. La relación de moles entre reactivo y producto se obtiene de la ecuación ajustada. A veces se cree equivocadamente que en las reacciones se utilizan siempre las cantidades exactas de reactivos. Sin embargo, en la práctica lo normal suele ser que se use un exceso de uno o más reactivos, para conseguir que reaccione la mayor cantidad posible del reactivo menos abundante.
Cuando una reacción se detiene porque se acaba uno de los reactivos, a ese reactivo se le llama reactivo limitante.
Aquel reactivo que se ha consumido por completo en una reacción química se le conoce con el nombre de reactivo limitante pues determina o limita la cantidad de producto formado.
Reactivo limitante es aquel que se encuentra en defecto basado en la ecuación química ajustada.
Ejemplo 1: Para la reacción:

¿Cuál es el reactivo limitante si tenemos 10 moléculas de hidrógeno y 10 moléculas de oxígeno?
Necesitamos 2 moléculas de H2 por cada molécula de O2
Pero tenemos sólo 10 moléculas de H2 y 10 moléculas de O2.
La proporción requerida es de 2 : 1
Pero la proporción que tenemos es de 1 : 1
Es claro que el reactivo en exceso es el O2 y el reactivo limitante es el H2
Como trabajar con moléculas es lo mismo que trabajar con moles.
Si ahora ponemos 15 moles de H2 con 5 moles de O2 entonces como la estequiometría de la reacción es tal que 1 mol de O2 reaccionan con 2 moles de H2, entonces el número de moles de O2 necesarias para reaccionar con todo el H2 es 7,5, y el número de moles de H2 necesarias para reaccionar con todo el O2es 10.
Es decir, que después que todo el oxígeno se ha consumido, sobrarán 5 moles de hidrógeno. El O2 es el reactivo limitante
Una manera de resolver el problema de cuál es el reactivo es el limitante es:
El reactivo limitante será aquel que produce la menor cantidad de producto.
Ejemplo 2: Se necesita un cierre, tres arandelas y dos tuercas para construir una baratija. Si el inventario habitual es 4,000 cierres, 12,000 arandelas y 7,000 tuercas. ¿Cuantas baratijas se pueden producir?
La ecuación correspondiente será:

En esta reacción, 1 mol de cierres, 3 moles de arandela y 2 moles de tuercas reaccionan para dar 1 mol de baratijas.
1) Divide la cantidad de cada reactivo por el número de moles de ese reactivo que se usan en la ecuación ajustada. Así se determina la máxima cantidad de baratijas que pueden producirse por cada reactivo.
Cierres: 4,000 / 1 = 4,000
Arandelas: 12,000 / 3 = 4,000
Tuercas: 7,000 / 2 = 3,500
Por tanto, el reactivo limitante es la tuerca.
2) Determina el número de baratijas que pueden hacerse a partir del reactivo limitante. Ya que el reactivo limitante es la tuerca, el máximo número de baratijas que pueden hacerse viene determinado por el número de tuercas. Entran dos tuercas en cada baratija, de modo que el número de bsratijas que pueden producirse, de acuerdo con la estequiometría del proceso es: 7,000 / 2 = 3,500 baratijas
Supongamos que se mezclan 637,2 g de NH3 con 1142 g de CO2. ¿Cuántos gramos de urea [(NH2)2CO] se obtendrán?
1) Primero tendremos que convertir los gramos de reactivos en moles:
637,2 g de NH3 son 37,5 moles
1142 g de CO2 son 26 moles
2) Ahora definimos la proporción estequiométrica entre reactivos y productos:
a partir de2 moles de NH3 se obtiene1 mol de (NH2)2CO
a partir de 1 mol de CO2 se obtiene 1 mol de (NH2)2CO
3) Calculamos el número de moles de producto que se obtendrían si cada reactivo se consumiese en su totalidad:
a partir de37,5 moles de NH3 se obtienen 18,75 moles de (NH2)2CO
a partir de 26 moles de CO2 se obtienen 26 moles de (NH2)2CO
4) El reactivo limitante es el (NH3) y podremos obtener como máximo 18.75 moles de urea.
5) Y ahora hacemos la conversión a gramos: 18,75 moles de (NH2)2CO son 1125 g.
18.1. Rendimiento
Se cree equivocadamente que las reacciones progresan hasta que se consumen totalmente los reactivos, o al menos el reactivo limitante.
Arandelas: 12,000 / 3 = 4,000
Tuercas: 7,000 / 2 = 3,500
Por tanto, el reactivo limitante es la tuerca.
2) Determina el número de baratijas que pueden hacerse a partir del reactivo limitante. Ya que el reactivo limitante es la tuerca, el máximo número de baratijas que pueden hacerse viene determinado por el número de tuercas. Entran dos tuercas en cada baratija, de modo que el número de bsratijas que pueden producirse, de acuerdo con la estequiometría del proceso es: 7,000 / 2 = 3,500 baratijas
Ejemplo 3: Considere la siguiente reacción:


1) Primero tendremos que convertir los gramos de reactivos en moles:
637,2 g de NH3 son 37,5 moles
1142 g de CO2 son 26 moles
2) Ahora definimos la proporción estequiométrica entre reactivos y productos:
a partir de2 moles de NH3 se obtiene1 mol de (NH2)2CO
a partir de 1 mol de CO2 se obtiene 1 mol de (NH2)2CO
3) Calculamos el número de moles de producto que se obtendrían si cada reactivo se consumiese en su totalidad:
a partir de37,5 moles de NH3 se obtienen 18,75 moles de (NH2)2CO
a partir de 26 moles de CO2 se obtienen 26 moles de (NH2)2CO
4) El reactivo limitante es el (NH3) y podremos obtener como máximo 18.75 moles de urea.
5) Y ahora hacemos la conversión a gramos: 18,75 moles de (NH2)2CO son 1125 g.
18.1. Rendimiento
Se cree equivocadamente que las reacciones progresan hasta que se consumen totalmente los reactivos, o al menos el reactivo limitante.
La cantidad real obtenida del producto, dividida por la cantidad teórica máxima que puede obtenerse (100%) se llama rendimiento.
La cantidad de producto que debiera formarse si todo el reactivo limitante se consumiera en la reacción, se conoce con el nombre de rendimiento teórico.
A la cantidad de producto realmente formado se le llama simplemente rendimiento o rendimiento de la reacción. Es claro que siempre se cumplirá la siguiente desigualdad
Rendimiento de la reacción ≦ rendimiento teórico
Razones de este hecho:
- es posible que no todos los productos reaccionen
- es posible que haya reacciones laterales que no lleven al producto deseado
- la recuperación del 100% de la muestra es prácticamente imposible
Ejemplo: La reacción de 6,8 g de H2S con exceso de SO2, según la siguiente reacción, produce 8,2 g de S. ¿Cual es el rendimiento?

(Pesos Atómicos: H = 1,008, S = 32,06, O = 16,00).
En esta reacción, 2 moles de H2S reaccionan para dar 3 moles de S.
1) Se usa la estequiometría para determinar la máxima cantidad de S que puede obtenerse a partir de 6,8 g de H2S. (6,8/34) x (3/2) x 32 = 9,6 g
2) Se divide la cantidad real de S obtenida por la máxima teórica, y se multiplica por 100. (8,2/9,6) x 100 = 85,4%
Ejemplo: La masa de SbCl3 que resulta de la reacción de 3,00 g de antimonio y 2,00 g de cloro es de 3,65 g. ¿Cuál es el rendimiento?

(Pesos Atómicos: Sb = 121,8, Cl = 35,45)
En esta reacción, 1 mol de Sb4 y 6 moles de Cl2 reaccionan para dar 4 moles de SbCl3.
1) Calcular el número de moles que hay de cada reactivo:
Peso Molecular del Sb4: 487,2 número de moles de Sb4 = 3/487,2 = 0,006156
Peso Molecular del Cl2: 70,9 número de moles de Cl2 = 2/70,9 = 0,0282
2) Comparar con la relación de coeficientes en la ecuación ajustada. La relación es de 1 mol de Sb4 a 6 moles de Cl2. Usando la estequiometría: 0,00656/0,0282 = 1/4,3 > 1/6 de modo que el reactivo limitante es el Cl2. Nosotros sólo tenemos 0,0282 moles de Cl2.
3) Usar la estequiometría para determinar la máxima cantidad de SbCl3 que puede obtenerse con 2,00 g de Cl2 (el reactivo limitante).

4) Dividir la cantidad real de SbCl3 obtenida por la máxima teórica y multiplicar por 100. (3,65/4,29) x 100 = 85,08%
18.2. Algunos conceptos
Reactivo limitante. Es aquel reactivo concreto de entre los que participan en una reacción cuya cantidad determina la cantidad máxima de producto que puede formarse en la reacción.
Proporción de reacción. Cantidades relativas de reactivos y productos que intervienen en una reacción. Esta proporción puede expresarse en moles, milimoles o masas.
Rendimiento real. Cantidad de producto puro que se obtiene en realidad de una reacción dada. Compárese con rendimiento teórico.
Rendimiento teórico. Cantidad máxima de un producto específico que se puede obtener a partir de determinadas cantidades de reactivos, suponiendo que el reactivo limitante se consume en su totalidad siempre que ocurra una sola reacción y se recupere totalmente el producto. Compárese con rendimiento.
Rendimiento porcentual. Rendimiento real multiplicado por 100 y dividido por el rendimiento teórico.
Porcentaje de pureza. El porcentaje de un compuesto o elemento específico en una muestra impura.
19. TIPOS DE REACCIONES QUÍMICAS
Existen infinidad de reacciones químicas. Por ello, conviene clasificarlas para sistematizar su estudio.
Se pueden clasificar las reacciones químicas según muchos criterios, veremos algunos de ellos:
Según la naturaleza de las sustancias que intervienen en la reacción.
Según la utilidad o aplicación de la reacción.
Según el mecanismo de la reacción.
Lógicamente una misma reacción puede clasificarse atendiendo a diferentes criterios y clasificaciones.
Existen infinidad de reacciones químicas. Por ello, conviene clasificarlas para sistematizar su estudio.
Se pueden clasificar las reacciones químicas según muchos criterios, veremos algunos de ellos:
Según la naturaleza de las sustancias que intervienen en la reacción.
Según la utilidad o aplicación de la reacción.
Según el mecanismo de la reacción.
Lógicamente una misma reacción puede clasificarse atendiendo a diferentes criterios y clasificaciones.
19.1. Reacciones de Síntesis o Composición
En estas reacciones, dos o más elementos o compuestos se combinan, resultando en un solo producto.
Síntesis Química: la combinación de dos o mas sustancias para formar un solo compuesto.
A + B ------------ C
(donde A y B pueden ser elementos o compuestos)
|
Dos elementos se combinarán para formar el compuesto binario correspondiente. En este caso, el aluminio y el oxígeno formarán el óxido de aluminio. La ecuación que representa la reacción es la siguiente:
4 Al (s) + 3 O2 (g) à 2 Al2O3 (s)
19.2. Reacciones de Descomposición o Análisis
Estas reacciones son inversas a la síntesis y son aquellas en la cuales se forman dos o más productos a partir de un solo reactante, usualmente con la ayuda del calor o la electricidad.
Descomposición Química: la formación de dos o mas sustancias a partir de un solo compuesto.
A ------------------- B + C
(donde B y C pueden ser elementos o compuestos)
|
Un compuesto binario se descompone en los elementos que lo conforman. En este caso, el óxido de mercurio (II) se descompone para formar los elementos mercurio y oxígeno. La ecuación que representa la reacción es la siguiente:
2 HgO (s) --------- 2 Hg (l) + O2 (g)
Estas reacciones son aquellas en las cuales un átomo toma el lugar de otro similar pero menos activo en un compuesto. En general, los metales reemplazan metales (o al hidrógeno de un ácido) y los no metales reemplazan no metales. La actividad de los metales es la siguiente, en orden de mayor actividad a menor actividad: Li, K, Na, Ba, Ca, Mg, Al, Zn, Fe, Cd, Ni, Sn, Pb, (H), Cu, Hg, Ag, Au. El orden de actividad de los no metales mas comunes es el siguiente: F, O, Cl, Br, I, siendo el flúor el más activo.
Desplazamiento Químico: un elemento reemplaza a otro similar y menos activo en un compuesto.
AB + C --------- CB + A ó AB + C ------------ AC + B
(dónde C es un elemento más activo que un metal A o un no metal B)
|
El magnesio es un metal más activo que el cobre y por tanto, lo reemplazará en el compuesto, formando sulfato de magnesio. A la vez, el cobre queda en su estado libre como otro producto de la reacción. La ecuación que representa la reacción es la siguiente:
Mg (s) + CuSO4 (ac) --------- MgSO4 (ac) + Cu (s)
El flúor es un no metal más activo que el oxígeno y por tanto, lo reemplazará en el compuesto, formando fluoruro de sodio. A la vez, el oxígeno queda en su estado libre como otro producto de la reacción. La ecuación que representa la reacción es la siguiente:
2 F2 (g) + 2 Na2O (ac) -------- 4 NaF (ac) + O2 (g)
Estas reacciones son aquellas en las cuales el ión positivo (catión) de un compuesto se combina con el ión negativo (anión) del otro y viceversa, habiendo así un intercambio de átomos entre los reactantes. En general, estas reacciones ocurren en solución, es decir, que al menos uno de los reactantes debe estar en solución acuosa.
Doble Desplazamiento Químico: los reactantes intercambian átomos – el catión de uno se combina con el anión del otro y viceversa.
AB + CD ------------- AD + CB
|
En esta reacción, la plata reemplaza al hidrógeno del ácido, formando cloruro de plata. Al mismo tiempo, el hidrógeno reemplaza a la plata, formando ácido nítrico con el nitrato. La ecuación que representa la reacción es la siguiente:
AgNO3 (ac) + HCl (ac) ---------- HNO3 (ac) + AgCl (s)
19.5. Reacciones de Neutralización
Estas reacciones son de doble desplazamiento o intercambio. Su particularidad es que ocurren entre un ácido y una base y los productos de la reacción son agua y una sal formada por el catión de la base y el anión del ácido.
Por ejemplo, la reacción entre el ácido sulfúrico y el hidróxido de sodio resulta en la formación de agua y sulfato de sodio. La ecuación que representa esta reacción es la siguiente:
H2SO4 (ac) + 2 NaOH (ac) --------- 2 H2O (l) + Na2SO4 (ac)
Estas reacciones ocurren cuando un hidrocarburo orgánico (un compuesto que contiene carbono e hidrógeno) se combina con el oxígeno, formando agua y dióxido de carbono como productos de la reacción y liberando grandes cantidades de energía. Las reacciones de combustión son esenciales para la vida, ya que la respiración celular es una de ellas.
Combustión: un hidrocarburo orgánico reacciona con el oxígeno para producir agua y dióxido de carbono.
hidrocarburo + O2 --------- H2O + CO2
|
En esta reacción, la glucosa es un hidrocarburo que reacciona con el oxígeno, resultando en los productos de la combustión – el agua y el dióxido de carbono. La ecuación que representa la reacción es la siguiente:
C6H12O6 + O2 ----------- H2O + CO2
| |
| |
| |
|
ANIMACIONES
19.7. Otra forma de clasificación
19.7.1. Según su naturalezaDesde el siglo XIX la química se dividió en dos grandes ramas o partes: la química orgánica y la química inorgánica.
Inicialmente la química orgánica era la química de los seres vivos, mientras que la inorgánica la de los seres inertes.
Actualmente la química orgánica es la química de los compuestos del carbono. Por tanto, son reacciones orgánicas aquellas en la que las sustancias que participan son compuestos en los que el elemento fundamental es carbono.
- Combustión de la madera
- Digestión de los alimentos, etc.
- LLuvia ácida
- Formación de estalactitas
- Oxidación del hierro
19.7.2. Según su funcionalidad
Otra posible clasificación es mediante la utilidad o funcionalidad de las reacciones.
Otra posible clasificación es mediante la utilidad o funcionalidad de las reacciones.
- Reacciones de síntesis. Aquellas cuya finalidad es la obtención de una sustancia química determinada.
- Obtención de medicinas
- Obtención de detergentes y plásticos
- Reacciones para obtener energía. Reacciones que al producirse liberan gran cantidad de energía, normalmente luz o calor.
- Combustión de la gasolina
- Funcionamiento de una pila
- Reacciones de degradación. Son aquellas en las que un producto químico se destruye, transformándose otros diferentes.
- Descomposición de un animal
- Oxidación del hierro
- Reacciones de interés industrial.Aquellas empleadas en la industria para obtener un producto químico en gran cantidad. Suelen ser muchas reacciones concatenadas.
- Obtención de sustamcias como el metano, ácido clorhídrico, sosa caústica, etc.
Atendiendo al mecanismo de las reacciones se pueden distinguir los siguientes tipos:
- Ácido-base. Una sustancia, llamada ácido transfiere protón/es a otra, llamada base.
- Reacción entre el bicarbonato y el vinagre
- Redox. Una sustancia, llamada reductor, transfiere electrón/es a otra, denominada oxidante.
- Respiración
- Fotosíntesis
- Precipitación. Son aquellas en las se forma una sustancia sólida que no se disuelve en el medio de reacción.
- Formación de estalactitas
- Precipitación de cal en las cañerias
- Complejación. En estas reacciones se forma o destruye un compuesto de coordinación. Un compuesto de coordinación está formado por un metal al que se unen varios compuestos químicos llamados ligandos.
- Solvatación de iones
- Unión de la hemoglobina con el oxígeno
Existen muchas reacciones químicas de interés, ya sea por su utilidad, extensión, repercusión, peligrosidad, etc. En este apartado trataremos las siguientes:
- Fotosíntesis.
- Digestión y respiración.
- Lluvia ácida.
- Corrosión de metales.
- Combustión.
- Obtención industrial de sustancias.
- Descomposición del ozono.
- Reacciones electroquímicas.
- Industria petroquímica.
19.8. Peligrosidad de las sustancias químicas.
Muchos de los reactivos (y también de los productos químicos) pueden ser peligrosos por diferentes causas. Por ello, se debe indicar en su envase las advertencias y medidas de precaución que se deben a la hora de manipularlos.
Muchos de los reactivos (y también de los productos químicos) pueden ser peligrosos por diferentes causas. Por ello, se debe indicar en su envase las advertencias y medidas de precaución que se deben a la hora de manipularlos.
Aunque la normativa sobre peligrosidad de sustancias químicas es muy amplia, indicamos a continuación los pictogramas más frecuentes que conviene conocer a este respecto.
Sustancia explosiva
|
Sustancia comburente o favorecedora de incendios
| ||
Sustancia inflamable
|
Sustancia nociva o irritante
| ||
Sustancia corrosiva
|
Sustancia peligrosa para el medioambiente
| ||
Sustancia tóxica
|
Sustancia radiactiva
|
20. PROCESOS QUÍMICOS INDUSTRIALES
20.1. Siderurgia
El proceso de obtención de los metales a partir de sus minerales recibe el nombre de metalurgia. Si nos referimos específicamente a la obtención del hierro, hablamos de siderurgia.
El proceso de obtención de los metales a partir de sus minerales recibe el nombre de metalurgia. Si nos referimos específicamente a la obtención del hierro, hablamos de siderurgia.
Las siderurgias integrales (como Acelor-
Mttal, en Asturias) realizan el proceso completo: obtención del arrabio (hierro fundido) a partir del
mineral de hierro y su transformación posterior en acero (planchas, bobinas,
alambre).
El hierro se obtiene en los altos hornos
a partir de sus minerales, normalmente hematita u oligisto (Fe2O3).
El mineral se tritura y lava con el fin de aumentar su riqueza en óxido y
después se aglomera con otros minerales para formar pequeñas bolitas llamadas pelets.
Como material reductor se utiliza el carbón de coque, obtenido a partir de la hulla.
Para obtener el coque la hulla se somete
al proceso denominado destilación seca que consiste, fundamentalmente, en un
calentamiento a temperaturas entre 500-1000 0C sin contacto con el
aire. En este proceso se elimina el alquitrán, gases y agua, obteniéndose un
carbón con un alto contenido en carbono (90-95 %) que no produce cenizas y que,
además, presenta una gran resistencia, pudiendo resistir los grandes pesos que
deberá soportar en el alto horno.
El tercer ingrediente usado en la
obtención del hierro es la piedra caliza (CaCO3), llamada fundente, cuya misión principal es
combinarse con la parte no aprovechable del mineral (ganga) para formar la
escoria.
Los tres ingredientes: pelets (mineral de hierro), coque y
fundente se almacenan en tolvas cerca del alto horno y se cargan en
vagonetas (skips) que ascienden por un plano inclinado hasta el tragante donde vierten
los materiales.
El alto horno consta de dos troncos de
cono, de distinta longitud, unidos por su base más ancha. El cono superior
recibe el nombre de cuba y el
inferior (cuya altura es, aproximadamente, 1/5 del total del horno) etalaje.
Todo el horno está revestido interiormente de ladrillos refractarios.
Para lograr las altas temperaturas que
se necesitan en el proceso se inyecta aire caliente (500 - 1000 0C)
por la parte inferior del horno a través de las toberas.
En el interior del horno se producen una
serie de reacciones químicas que terminan produciendo hierro líquido en la
parte más baja del mismo o crisol.
La temperatura del horno va desde unos
400 0C en la parte superior hasta unos 1800 0C en el
crisol, y la mezcla de mineral de hierro, coque y fundente va descendiendo
produciéndose la reducción paulatina del óxido a metal:
En la parte inferior del horno (a nivel de las toberas) se produce CO2 como consecuencia de la combustión del carbón:
El CO2 al ascender y encontrase con el coque incandescente se transforma en CO :
El CO asciende y reduce al óxido dejando libre el metal:
El hierro fundido y la escoria (que flota sobre el líquido) se depositan en el crisol en la parte inferior del horno.
En la región
media del horno la caliza se descompone (a una temperatura de unos 1000 0C)
en óxido de calcio y se combina con las impurezas formando la escoria:
En la parte más ancha del horno (vientre) se alcanza la temperatura de fusión del hierro (1300 0C), ya que al estar combinado con carbono tiene una temperatura de fusión inferior a la del hierro puro (1500 0C), y la de la escoria. La escoria al ser menos densa que el hierro fundido flota sobre este protegiéndolo de posibles oxidaciones.El hierro fundido y la escoria (que flota sobre el líquido) se depositan en el crisol en la parte inferior del horno.
Cada seis horas, aproximadamente, se
produce el sangrado del horno
rompiéndose el tapón de arcilla refractaria de la piquera y recogiendo el
arrabio líquido en cucharones o vagones torpedo para su posterior traslado a
las acerías.
A través de la bigotera (situada en un
plano superior a la piquera) se recoge la escoria que se aprovecha para
rellenos y otros usos.
Los gases que a elevada temperatura
salen del horno se recogen y, a través de tuberías, son devueltos a las estufas
para ser utilizados como combustible para calentar los gases que se inyectan en
el horno.
En la producción de una tonelada de
hierro se consumen 1500 kg de mineral, 750 kg de coque y 225 kg de caliza.
20.2. Obtención del acero
El arrabio que sale del horno es bastante quebradizo debido al alto contenido en C (5%). Con el fin de mejorar sus propiedades mecánicas el hierro se transforma en acero en las acerías a las que llega en estado líquido en los llamados torpedos.
El arrabio que sale del horno es bastante quebradizo debido al alto contenido en C (5%). Con el fin de mejorar sus propiedades mecánicas el hierro se transforma en acero en las acerías a las que llega en estado líquido en los llamados torpedos.
En las acerías el arrabio se somete a un proceso de afino para eliminar el exceso de
carbono. También se añaden otros metales: Cr, Mn, Ni, W, V, Mo ... etc para
obtener aceros especiales: aceros inoxidables, al cromo... etc.
El afino se puede hacer mediante distintos procedimientos,
siendo el más corriente el que emplea los llamados convertidores.
El proceso original para la obtención de acero fue
desarrollado por Henry Bessemer (1813-1898).
Por eso los primeros convertidores recibieron el nombre de convertidores Bessemer.
Los actuales llamados convertidores LD (de los topónimos de
las ciudades austriacas Linz y Donawitz) usan para el refinado del acero, no
aire como los primitivos Bessemer, sino oxígeno prácticamente puro.
En el convertidor se introduce el
arrabio mezclado con chatarra y a continuación se introduce una lanza por la
que se inyecta oxígeno a una elevada presión con caliza en polvo. El oxígeno se
proyecta contra la superficie provocando que el C y las impurezas (Si, P, S...)
se eliminen en forma de óxidos gaseosos o compuestos sólidos que flotan sobre
el acero líquido formando la escoria.
La temperatura del proceso es de unos 1700 0C y dura unos 30 minutos. Al final el convertidor se vuelca para recuperar el acero.20.3. Obtención del ácido sulfúrico.
La forma más habitual de producción de ácido sulfúrico es a partir de la oxidación de sus óxidos mediante un proceso catalítico denominado método de (doble) contacto.
Los óxidos de azufre pueden provenir de
la tostación (calentamiento en presencia de una corriente de aire) de sulfuros,
tal y como se hace en Asturiana de Zinc (AZSA), donde los concentrados de
ZnS se tuestan en hornos (a unos 1000
0C) para convertirlos en óxido de cinc:
El sólido resultante de la tostación
(llamado calcine) es una mezcla de óxido de cinc impurificado con óxidos
de otros metales tales como Fe, Pb, Ca, Cu, Co, Cd.. y es lo que se emplea en
la obtención del zinc mediante electrolisis.
El dióxido de azufre resultante, después
de purificarlo de las impurezas (mercurio en estado gaseoso entre ellas), se oxida
a trióxido de azufre en un proceso reversible en el que se utiliza V2O5
como catalizador a unos 400-450 0C y presiones entre 1 y 2 atm
El paso siguiente consiste en
transformar el SO3 en ácido sulfúrico según:
No obstante la reacción directa del
trióxido de azufre con agua es una reacción violenta e incontrolable por lo que
el proceso se lleva cabo disolviéndolo
primeramente en ácido sulfúrico concentrado para formar ácido disulfúrico (H2S2O7) u oleum (debido a su aspecto aceitoso)
que puede posteriormente reaccionar con el agua de forma segura:
AZSA vende
unas 20 000 toneladas anuales de oleum. Su uso se centra en sectores como la
fabricación de detergentes, la producción de metacrilato, fabricación de
explosivos o en la producción de ácido fluorhídrico.
El ácido sulfúrico
producido tiene una concentración del 97 - 99 %.
En 2011 la
compañía de San Juan de Nieva produjo 671 114 toneladas de ácido sulfúrico.
El
ácido sulfúrico es un producto muy usado en un gran número de procesos
industriales, ya que es utilizado en la fabricación de fertilizantes, pinturas y pigmentos,
explosivos, papel, plástico, detergentes, textiles, baterías y una gran
variedad de productos químicos. También es utilizado en tratamientos de minerales,
refinado de metales, procesos petroquímicos y tratamiento de aguas. La producción
global de ácido sulfúrico es superior a 165 millones de toneladas anuales.
20.4. Obtención del ácido nítrico
El ácido nítrico (HNO3) se produce industrialmente mediante la oxidación catalítica del amoniaco (NH3), procedimiento que recibe el nombre de método Ostwald(1)
El ácido nítrico (HNO3) se produce industrialmente mediante la oxidación catalítica del amoniaco (NH3), procedimiento que recibe el nombre de método Ostwald(1)
En una
primera etapa el amoniaco se oxida a monóxido de nitrógeno calentándolo (800 0C)
en presencia de un catalizador de platino-rodio:
El monóxido de nitrógeno se oxida
posteriormente (no es necesario catalizador) a dióxido:
que
se disuelve en agua para dar una mezcla de ácido nitroso y nítrico:
La mezcla se calienta para transformar el
ácido nitroso en nítrico. El NO generado puede reciclarse para producir más
ácido:
El ácido nítrico se emplea ampliamente
en la industria para producir fertilizantes, fármacos o explosivos.
20.5. Obtención del amoniaco
La producción industrial del amoniaco está basada en el llamado proceso Haber(2) que utiliza como materiales de partida N2(g) e H2(g).
La producción industrial del amoniaco está basada en el llamado proceso Haber(2) que utiliza como materiales de partida N2(g) e H2(g).
El
nitrógeno se obtiene a partir del aire y el hidrógeno a partir del agua
haciendo pasar vapor de agua sobre carbón calentado:
El
nitrógeno e hidrógenos obtenidos se hacen reaccionar para producir amoniaco
según un proceso reversible y exotérmico:
Termodinámicamente la producción de
amoniaco está favorecido a temperaturas bajas y presiones altas, pero si
bajamos la temperatura la velocidad de la reacción es muy pequeña haciendo
inviable económicamente el proceso. Haber resolvió el problema trabajando a
unos 500 0C y usando un catalizador de hierro y óxidos de potasio y
aluminio que permiten que la reacción transcurra a una velocidad apropiada.
En cuanto a la presión se trabaja a
presiones elevadas (entre 200 y 1000 atm). No se utilizan presiones mayores
debido al coste adicional que esto supone.
A 500-600ºC y unas 900 atm, la
conversión de N2 y H2 en amoniaco llega prácticamente a un
40%. A esta presión el amoniaco se obtiene en forma líquida, mientras el
nitrógeno y el hidrógeno que no han reaccionado permanecen en estado gaseoso y
son reciclados para volver a ser
utilizados en el proceso.
El
proceso Haber tuvo una repercusión social y económica enorme al producir amoniaco
de forma barata. El amoniaco es un producto fundamental para la producción de
fertilizantes que, de esta manera, se abarataron considerablemente
popularizando su uso, lo que se tradujo en un aumento de los rendimientos en la producción agrícola.






24. OTROS CONTENIDOS
Teoría enlace químico
Reacciones químicas
Reacciones químicas y ejercicios
Reacciones químicas y ejercicios 2
Reacciones químicas y cálculos estequiométricos
25. VÍDEOS
La reacción entre el ácido clorhídrico y el hierro
Pila Daniell
Electrólisis | Disolución acuosa de sulfato de cobre (II)
Balanceo de ecuaciones redox
Factor que afecta la velocidad : la temperatura
Factor que afecta la velocidad : la concentración Vídeo 1
Vídeo 2
Vídeo 3
Vídeo 4
Oxidación de una manzana
Combustión del metano
Combustión del propano
Reaccione químicas
Reacciones químicas espectaculares
Reacciones Químicas
Reacción del Cu con el HNO3
Reacción de obtención del H2O
Reacción del Na y K con el H2O
Reacción de obtención de NH3
Reacción del Zn con el HCl
Ley de Lavoisier
Reactivo limitante
Reactivo limitante (v.i)
Factor que afecta la velocidad : la temperatura
Factor que afecta la velocidad : la concentración Vídeo 1
Vídeo 2
Vídeo 3
Vídeo 4
Oxidación de una manzana
Combustión del metano
Combustión del propano
Reaccione químicas
Reacciones químicas espectaculares
Reacciones Químicas
Reacción del Cu con el HNO3
Reacción de obtención del H2O
Reacción del Na y K con el H2O
Reacción de obtención de NH3
Reacción del Zn con el HCl
Ley de Lavoisier
Reactivo limitante
Reactivo limitante (v.i)





















































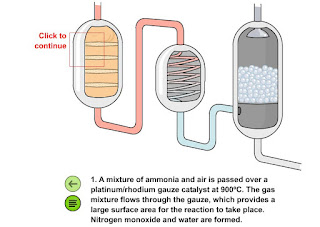































No hay comentarios:
Publicar un comentario