ÍNDICE
|
1. Masa atómica. Concepto y tipos de isótopos. 14. Concepto y tipos de iones. 1. Sistema periódico de los elementos químicos. 1. Evolución histórica. 2. Estructura e importancia de la tabla periódica. 15. Uniones entre átomos: enlace químico. 16. Masas atómicas y moleculares. Concepto de unidad de masa 1. Masas atómicas 2. Cálculo de la masa molecular 17. Tipos de enlace químico 1. Enlace iónico 2. Enlace covalente 3. Enlace metálico 4. Fuerzas intermoleculares: puentes de hidrógeno y fuerzas de Van der Waals 18. Fórmulas e información 19. Prácticas 20. Cuestones 21. Visor de moléculas 22. Otros contenidos 23. Vídeos |
1. ESQUEMAS
2. PRESENTACIONES







¿Cómo se enlazan?
Primera parte del cronograma sobre la estructura de la materia
Cronograma completo sobre la estructura de la materia
Estructura del átomo
Breve historia de los elementos químicos más importantes
El Sistema Periódico
3. CONTENIDOS ANIMADOS
4. CONCEPTO Y TIPOS DE SUSTANCIAS PURAS
Cualquier sustancia material puede ser de 2 tipos: pura e impura (o mezcla). Si en el tema anterior estudiamos las sustancias impuras, en este tema estudiaremos el segundo tipo. Recordemos que una sustancia pura es aquella que está formada por un solo tipo de materia o de sustancia, y que puede ser de 2 tipos:
- Elemento: es aquella sustancia pura que no puede descomponerse en otras sustancias más sencillas. Todos los elementos químicos que se conocen aparecen en la tabla periódica
| Sólidos | Líquidos | Gases | Sintéticos |
- Compuesto: es aquella sustancia pura que puede descomponerse en otras sustancias más sencillas, es decir, un compuesto estará formado por 2 o más elementos químicos diferentes. Los compuestos se escriben abreviadamente utilizando fórmulas químicas (ver apartado 4.1). Ejemplos son el agua (H2O), dióxido de carbono (CO2), amoníaco (NH3), etc.



| Símbolos de los elementos Empareja los nombres y los símbolos de los elementos químicos. | Tabla periódica Juega y aprende sobre los elementos químicos y su situación en la tabla periódica. | ||
| Tetris tabla periódica Comprueba tus conocimientos sobre la tabla periódica colocando los elementos en su lugar correcto. |
5. EL ÁTOMO.
5.1. EL ÁTOMO EN LA ANTIGUEDAD
Los filósofos griegos discutieron mucho acerca de la naturaleza de la materia y concluyeron que el mundo era más simple de lo que parecía. Algunas de sus ideas de mayor relevancia fueron:
En el siglo V a. C., Leucipo sostenía que había un sólo tipo de materia y pensaba que si dividíamos la materia en partes cada vez más pequeñas, obtendríamos un trozo que no se podría cortar más. Demócrito llamó a estos trozos átomos ("sin división").
La filosofía atomista de Leucipo y Demócrito podía resumirse en:
1.- Los átomos son eternos, indivisibles, homogéneos e invisibles.
2.- Los átomos se diferencian en su forma y tamaño.
3.- Las propiedades de la materia varían según el agrupamiento de los átomos.
| ||
En el siglo IV a. C., Empédocles postuló que la materia estaba formada por 4 elementos: tierra, aire, agua y fuego.
| ||
Aristóteles, posteriormente, postula que la materia estaba formada por esos 4 elementos pero niega la idea de átomo, hecho que se mantuvo hasta 200 años después en el pensamiento de la humanidad.
| ||
5.2. CONCEPTO DE ÁTOMO
Si consiguiéramos dividir una sustancia en partes cada vez más pequeñas, llegaríamos a una partícula muy pequeña que tendría las mismas propiedades que uno cualquiera de los elementos químicos que forman la sustancia:
Un átomo es la partícula más pequeña que existe en la Naturaleza y que tiene las propiedades de un determinado elemento químico.
Así, un átomo de oro es la partícula más pequeña que existe en la Naturaleza y que tiene las propiedades del elemento químico oro.
6. TEORÍAS ATÓMICAS
En Física y en Química, un modelo es una explicación simplificada de la realidad para de esta manera hacerla más comprensible. De esta manera, el modelo atómico clásico intenta explicar de una manera simple cómo es un átomo por dentro (su estructura interna) para así entender sus propiedades y comportamiento.
Aunque, como acabamos de decir, un átomo es la partícula más pequeña con las mismas propiedades de un cierto elemento químico, ello no significa que sea indivisible. De hecho, en este apartado estudiaremos la estructura interna de un átomo, es decir, cómo es un átomo por dentro. Comenzaremos explicando las ideas atómicas de Dalton, para proseguir con el modelo atómico clásico.
6.1. Teoría atómica de Dalton
Fue establecida por el científico inglés John Dalton en 1808. A pesar de que en su época existían escasos avances técnicos, fue uno de los primeros científicos en afirmar (sin poder demostrarlo) que cualquier objeto debía estar formado por la unión de muchísimas partículas. Su teoría se basa en las siguientes ideas (o postulados):
- Cualquier objeto está formado por miles y miles de partículas indivisibles y muy pequeñas llamadas átomos.
- Los átomos del mismo elemento químico son iguales entre sí, es decir, tienen la misma masa y las mismas propiedades. Dalton asignó a cada átomo un símbolo especial; en la tabla de la derecha aparecen algunos de ellos.
- Los átomos de diferentes elementos químicos son distintos entre sí, es decir, tienen distintas masas y propiedades.
- Los compuestos químicos resultan de la unión más sencilla posible entre átomos de diferentes elementos.
6.2. Naturaleza eléctrica de la materia
Los fenómenos de electrización de la materia se conocen desde la Antigüedad. Así, los griegos sabían que algunas sustancias, como el ámbar (electrón, en griego), atraían trocitos de papel al ser frotados. Sin embargo, no fue hasta mediados del siglo XIX y principios del siglo XX hasta cuando se logró comprender perfectamente por qué sucedían estos fenómenos.
Hoy en día sabemos que la carga eléctrica puede ser positiva o negativa, y que puede transferirse (o pasar) de un objeto a otro (por ejemplo, cuando los frotamos). Por tanto, si los objetos pueden tener carga eléctrica y están formados por átomos, deducimos que los átomos no son indivisibles, sino que contienen carga eléctrica en su interior. En el siguiente apartado estudiaremos cómo se descubrieron y cuáles son esas partículas.
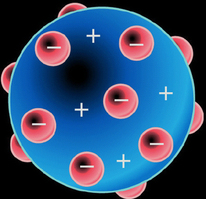
Uno de los primeros experimentos realizados para estudiar la estructura interna de un átomo fue realizado por el científico inglés J.J. Thomson en 1896. Utilizó un tubo de descarga de gases, en el cual introdujo una sustancia gaseosa a baja presión (muy pocas partículas); observó entonces que, tras aplicar una descarga eléctrica (o diferencia de potencial) entre 2 placas metálicas, aparecía un rayo que iba de una placa metálica a otra. Dedujo entonces que si dichos rayos, a los que llamó rayos catódicos, iban de la placa negativa a la positiva debían estar formados por partículas cargadas negativamente. Estas partículas, a las que llamó electrones, eran arrancadas de los átomos al aplicar la descarga eléctrica. Así, Thomson pensó que el átomo tenía la forma de una esfera maciza cargada positivamente en la que se incrustaban los electrones. La carga positiva y la negativa debían ser iguales para que el átomo fuera eléctricamente neutro (ver dibujo a la izquierda).
6.3. Modelo atómico de Thomson
Los experimentos de Thomson sobre los rayos catódicos en campos magnéticos y eléctricos dieron pie al descubrimiento del electrón he hizo posible medir la relación entre su carga y su masa; el experimento de gota de aceite de Millikan proporcionó la masa del electrón; el descubrimiento de la radioactividad (la emisión espontánea de radiación por átomos) fue una prueba adicional de que el átomo tiene una subestructura.
Una vez considerado el electrón como una partícula fundamental de la materia existente en todos los átomos, los físicos atómicos empezaron a especular sobre cómo estaban incorporadas estas partículas dentro de los átomos.
El modelo comúnmente aceptado era el que a principios del siglo XX propuso Joseph John Thomson, quién pensó que la carga positiva necesaria para contrarrestar la carga negativa de los electrones en un átomo neutro estaba en forma de nube difusa, de manera que el átomo consistía en una esfera de carga eléctrica positiva, en la cual estaban embebidos los electrones en número suficiente para neutralizar la carga positiva.




7. PARTÍCULAS SUBATÓMICAS
7.1. Descubrimiento del electrón
El primer experimento interesante que condujo a un modelo sobre la composición de los átomos, fue hecho por el físico inglés J. J. Thomson, entre los años 1898 a 1903, quién estudió la descarga eléctrica que se produce dentro de tubos al vacío parcial(algo de aire), llamados Tubos de rayos catódicos. El aire enrarecido sirve efectivamente para que, si alguna partícula pequeña se desplaza y choca una molécula de Nitrógeno u Oxígeno, se produzca una iluminación en la dirección del flujo de partículas de modo que pueda ser identificado. Thomson encontró que cuando un voltaje suficientemente alto (proveniente de una pila o bobina) era aplicado entre los electrodos como lo muestra la Figura, un rayo que el llamó rayos catódicos (porque comenzaba en el electrodo negativo de la pila), se producía. Este rayo viajaba hacia el electrodo (+) por lo que dedujo que se trataba de un flujo de partículas repelidas por el electrodo (-) que necesariamente significaba que eran partículas cargadas (-) atraídas por el electrodo (+) y que llamó desde entonces electrones e- .

Para demostrar que efectivamente se trataba de partículas cargadas (-) Thomson ideó colocar "otra pila" con electrodos (+) y (-) perpendiculares al haz que se origina en el polo (-), como lo muestra la figura en amarillo que sigue. Así, él también descubrió que el flujo se desviaba hacia el polo (+) de la pila.
Posteriormente, en 1911, el científico neozelandés Ernest Rutherford realizó otro experimento para comprobar si el modelo atómico de Thomson era cierto. Para ello, bombardeó una fina lámina de oro con partículas cargadas positivamente; observó entonces que casi todas las partículas atravesaban la lámina sin desviarse
7.2. Protones
Partículas subatómicas de carga eléctrica positiva y masa 1800 veces superior a la del electrón (p+).
El físico alemán E. Goldstein realizó algunos experimentos con un tubo de rayos catódicos con el cátodo perforado. Observó unos rayos que atravesaban al cátodo en sentido contrario a los rayos catódicos. Recibieron el nombre de rayos canales.
El estudio de estos rayos determinó que estaban formados por partículas de carga positiva, y que tenían una masa distinta según cuál fuera el gas que estaba encerrado en el tubo.
Al experimentar con hidrógeno se consiguió aislar la partícula elemental positiva o protón, cuya carga es la misma que la del electrón pero positiva, y su masa es 1837 veces mayor.
7.3. Neutrones
Partículas subatómicas de carga eléctrica nula y masa parecida a la del protón (n).
Mediante diversos experimentos se comprobó que la masa de protones y electrones no coincidía con la masa total del átomo; por tanto, el físico E.Rutherford supuso que tenía que haber otro tipo de partícula subatómica en el interior de los átomos. Estas partículas se descubrieron en 1932 por el físico J. Chadwick. Al no tener carga eléctrica recibieron el nombre de neutrones. El hecho de no tener carga eléctrica hizo muy difícil su descubrimiento.
Los neutrones son partículas sin carga y de masa algo mayor que la masa de un protón.
Para Ernest Rutherford, el átomo era un sistema planetario de electrones girando alrededor de un núcleo atómico pesado y con carga eléctrica positiva.
El módelo atómico de Rutherford puede resumirse de la siguiente manera:
- El átomo posee un núcleo central pequeño, con carga eléctrica positiva, que contiene casi toda la masa del átomo.
- Los electrones giran a grandes distancias alrededor del núcleo en órbitas circulares.
- La suma de las cargas eléctricas negativas de los electrones debe ser igual a la carga positiva del núcleo, ya que el átomo es eléctricamente neutro.
Rutherford no solo dio una idea de cómo estaba organizado un átomo, sino que también calculó cuidadosamente su tamaño (un diámetro del orden de 10-10 m) y el de su núcleo (un diámetro del orden de 10-14m). El hecho de que el núcleo tenga un diámetro unas diez mil veces menor que el átomo supone una gran cantidad de espacio vacío en la organización atómica de la materia.
Para analizar cual era la estructura del átomo, Rutherford diseñó un experimento:
El experimento consistía en bombardear una fina lámina de oro con partículas alfa (núcleos de helio). De ser correcto el modelo atómico de Thomson, el haz de partículas debería atravesar la lámina sin sufrir desviaciones significativas a su trayectoria. Rutherford observó que un alto porcentaje de partículas atravesaban la lámina sin sufrir una desviación apreciable, pero un cierto número de ellas era desviado significativamente, a veces bajo ángulos de difusión mayores de 90 grados. Tales desviaciones no podrían ocurrir si el modelo de Thomson fuese correcto.
De este resultado dedujo que el átomo estaba en realidad prácticamente hueco, de modo que debía tener una estructura parecida a la del Sistema Solar en la que podían diferenciarse 2 zonas:
- Zona central o núcleo: en ella se encuentran las partículas con carga positiva o protones, muy juntos entre sí.
- Zona externa o corteza: en ella se encuentran las partículas con carga negativa o electrones, girando alrededor del núcleo a una gran distancia de él.
De acuerdo con todo lo dicho, la estructura del átomo queda como se indica en la figura siguiente:
PARTÍCULAS ELEMENTALES DEL ÁTOMO
| |||
Partícula
|
Símbolo
|
Masa
|
Carga
|
Electrón
|
e-
|
9,11·10-31 kg
|
- 1,6·10-19 C
|
Protón
|
p+
|
1,673·10-27 kg
|
+ 1,6·10-19 C
|
Neutrón
|
n
|
1,675·10-27 kg
|
0
|
- Las masas del protón y del neutrón (también llamados nucleones) son casi iguales, y su valor es casi 1800 veces superior a la masa del electrón. Por tanto, la mayor parte de la masa de un átomo se encontrará en su núcleo.
- La materia suele ser eléctricamente neutra, y como sabemos que está formada por átomos deducimos que si un átomo es neutro, deberá tener el mismo número de protones en su núcleo que de electrones en su corteza.
- El átomo es divisible (está formado por partículas más pequeñas que él), en contra de lo que pensaba Dalton.

9. NUEVOS DESCUBRIMIENTOS
9.1. Naturaleza ondulatoria de la luz
Algunas veces la luz se manifiesta como onda. Otras veces se manifiesta como partícula. Todo depende de las circunstancias.
La luz es una radiación electromagnética, es decir, una onda de campos eléctricos y magnéticos. Las ondas electromagnéticas propagan energía mediante la vibración de un campo eléctrico y uno magnético perpendiculares. Las características que las definen y diferencian son:
Longitud de onda (λ). Es la distancia mínima entre dos puntos que están en el mismo estado de vibración.
Frecuencia (ν). Número de ciclos por unidad de tiempo. Su unidad en el SI es el hertz o hercio (Hz), equivalente a un (ciclo) s-1.
La relación de la longitud de onda con la frecuencia es la siguiente:
λ=c/ν
donde c es la velocidad de la luz.(c= 3 · 108 m/s)
9.2. Energía cuantificada y fotones
Planck postuló que la emisión de radiación electromagnética se produce en forma de "paquetes" o "cuantos" de energía (fotones). Esto significa que la radiación no es continua, es decir, los átomos no pueden absorber o emitir cualquier valor de energía, sino sólo unos valores concretos. La energía correspondiente a cada uno de los "cuantos" se obtiene multiplicando su frecuencia, ν, por la cte de Plank, h (h=6,626·10-34 Julios · segundo).
E = h · ν
La estructura electrónica de un átomo describe las energías y la disposición de los electrones alrededor del átomo. Gran parte de lo que se conoce acerca de la estructura electrónica de los átomos se averiguó observando la interacción de la radiación electromagnética con la materia.
Sabemos que el espectro de un elemento químico es característico de éste y que del análisis espectroscópico de una muestra puede deducirse su composición.
El origen de los espectros era desconocido hasta que la teoría atómica asoció la emisión de radiación por parte de los átomos con el comportamiento de los electrones, en concreto con la distancia a la que éstos se encuentran del núcleo.
El físico danés Niels Bohr, propuso un nuevo modelo atómico que se basa en tres postulados:
Primer Postulado: Los electrones giran alrededor del núcleo en órbitas estacionarias sin emitir energía
Segundo Postulado: Los electrones solo pueden girar alrededor del núcleo en aquellas órbitas para las cuales el momento angular del electrón es un múltiplo entero de h/2p.

siendo "h" la constante de Planck, m la masa del electrón, v su velocidad, r el radio de la órbita y n un número entero (n=1, 2, 3, ...) llamado número cuántico principal, que vale 1 para la primera órbita, 2 para la segunda, etc.Tercer postulado: Cuando un electrón pasa de una órbita externa a una más interna, la diferencia de energía entre ambas órbitas se emite en forma de radiación electromagnética.
Mientras el electrón se mueve en cualquiera de esas órbitas no radia energía, sólo lo hace cuando cambia de órbita. Si pasa de una órbita externa (de mayor energía) a otra más interna (de menor energía) emite energía, y la absorbe cuando pasa de una órbita interna a otra más externa. Por tanto, la energía absorbida o emitida será:
Bohr describió el átomo de hidrógeno con un protón en el núcleo, y girando a su alrededor un electrón.
En éste modelo los electrones giran en órbitas circulares alrededor del núcleo; ocupando la órbita de menor energía posible, o sea la órbita más cercana posible al núcleo.
Cada órbita se corresponde con un nivel energético que recibe el nombre de número cuántico principal, se representa con la letra " n " y toma valores desde 1 hasta 7 .
11. MODELO ACTUAL DEL ÁTOMO
11.1. Teoría de De Broglie
En el mundo macroscópico resulta muy evidente la diferencia entre una partícula y una onda; dentro de los dominios de la mecánica cuántica, las cosas son diferentes. Un conjunto de partículas, como un chorro de electrones moviéndose a una determinada velocidad puede comportarse según todas las propiedades y atributos de una onda, es decir: puede reflejarse, refractarse y difractarse.
Por otro lado, un rayo de luz puede, en determinadas circunstancias, comportarse como un chorro de partículas (fotones)con una cantidad de movimiento bien definida. Asi, al incidir un rayo de luz sobre la superficie lisa de un metal se desprenden electrones de éste (efecto fotoeléctrico). La energía de los electrones arrancados al metal depende de la frecuencia de la luz incidente y de la propia naturaleza del metal.
Según la hipótesis de De Broglie, cada partícula en movimiento lleva asociada una onda, de manera que la dualidad onda-partícula puede enunciarse de la siguiente forma: una partícula de masa m que se mueva a una velocidad v puede, en condiciones experimentales adecuadas, presentarse y comportarse como una onda de longitud de onda, λ. La relación entre estas magnitudes fue establecida por el físico francés Louis de Broglie en 1924.

cuanto mayor sea la cantidad de movimiento (mv) de la partícula menor será la longitud de onda (λ), y mayor la frecuencia (ν) de la onda asociada.
11.2. Principio de incertidumbre de Heisenberg
W. Heisenberg enunció el llamado principio de incertidumbre o principio de indeterminación, según el cual es imposible medir simultáneamente, y con precisión absoluta, el valor de la posición y la cantidad de movimiento de una partícula.
Es importante insistir en que la incertidumbre no se deriva de los instrumentos de medida, sino del propio hecho de medir. Con los aparatos más precisos imaginables, la incertidumbre en la medida continúa existiendo. Así, cuanto mayor sea la precisión en la medida de una de estas magnitudes mayor será la incertidumbre en la medida de la otra variable complementaria.
11.3. Capas y subcapas atómicas
Todos los orbitales con el mismo valor del número cuántico principal, n, se encuentran en la misma capa electrónica principal o nivel principal, y todos los orbitales con los mismos valores den y l están en la misma subcapa o subnivel.
El número de subcapas en una capa principal es igual al número cuántico principal, esto es, hay una subcapa en la capa principal con n=1, dos subcapas en la capa principal con n=2, y así sucesivamente. El nombre dado a una subcapa, independientemente de la capa principal en la que se encuentre, esta determinado por el número cuántico l, de manera que como se ha indicado anteriormente: l=0 (subcapa s), l=1 (subcapa p), l=2 (subcapa d) y l=3 (subcapa f).
La imagen de los orbitales empleada habitualmente por los químicos consiste en una representación del orbital mediante superficies límite que engloban una zona del espacio donde la probabilidad de encontrar al electrón es del 99%. La extensión de estas zonas depende básicamente del número cuántico principal, n, mientras que su forma viene determinada por el número cuántico secundario, l.
Los orbitales s (l=0) tienen forma esférica. La extensión de este orbital depende del valor del número cuántico principal, asi un orbital 3s tiene la misma forma pero es mayor que un orbital 2s.



Una vez descritos los cuatro número cuánticos, podemos utilizarlos para describir la estructura electrónica del átomo de hidrógeno:
El electrón de un átomo de hidrógeno en el estado fundamental se encuentra en el nivel de energía más bajo, es decir, n=1, y dado que la primera capa principal contiene sólo un orbital s, el número cuántico orbital es l=0. El único valor posible para el número cuántico magnético es ml=0. Cualquiera de los dos estados de spin son posibles para el electrón. Así podríamos decir que el electrón de un átomo de hidrógeno en el estado fundamental está en el orbital 1s, o que es un electrón 1s, y se representa mediante la notación:
1s1
en donde el superíndice 1 indica un electrón en el orbital 1s. Ambos estados de espín están permitidos, pero no designamos el estado de espín en esta notación.
11.4. Configuraciones electrónicas
Escribir la configuración electrónica de un átomo consiste en indicar cómo se distribuyen sus electrones entre los diferentes orbitales en las capas principales y las subcapas. Muchas de las propiedades físicas y químicas de los elementos pueden relacionarse con las configuraciones electrónicas.
Esta distribución se realiza apoyándonos en tres reglas: energía de los orbitales, principio de exclusión de Pauli y regla de Hund.
1. Los electrones ocupan los orbitales de forma que se minimice la energía del átomo. El orden exacto de llenado de los orbitales se estableció experimentalmente, principalmente mediante estudios espectroscópicos y magnéticos, y es el orden que debemos seguir al asignar las configuraciones electrónicas a los elementos. El orden de llenado de orbitales es:1s22s22p63s23p64s23d104p65s24d105p66s24f145d106p67s25f146d107p6
Empezando por la línea superior, sigue las flechas y el orden obtenido es el mismo que en la serie anterior. Debido al límite de dos electrones por orbital, la capacidad de una subcapa de electrones puede obtenerse tomando el doble del número de orbitales en la subcapa. Así, la subcapa s consiste en un orbital con una capacidad de dos electrones; la subcapa p consiste entres orbitales con una capacidad total de seis electrones; la subcapa d consiste en cinco orbitales con una capacidad total de diez electrones; la subcapa f consiste en siete orbitales con una capacidad total de catorce electrones.
En un determinado átomo los electrones van ocupando, y llenando, los orbitales de menor energía; cuando se da esta circunstancia el átomo se encuentra en su estado fundamental. Si el átomo recibe energía, alguno de sus electrones más externos pueden saltar a orbitales de mayor energía, pasando el átomo a un estado excitado
11.5. Principio de exclusión de Pauli.
En un átomo no puede haber dos electrones con los cuatro número cuánticos iguales.
Los tres primeros número cuánticos, n, l y ml determinan un orbital específico. Dos electrones, en un átomo, pueden tener estos tres números cuánticos iguales, pero si es así, deben tener valores diferentes del número cuántico de espín. Podríamos expresar esto diciendo lo siguiente: en un orbital solamente puede estar ocupado por dos electrones y estos electrones deben tener espines opuestos.
11.6. Regla de Hund.
Al llenar orbitales de igual energía (los tres orbitales p, los cinco orbitales d, o los siete orbitales f) los electrones se distribuyen, siempre que sea posible, con sus espines paralelos, es decir, desapareados.
Ejemplo:
La estructura electrónica del 7N es: 1s2 2s2 2px1 2py1 2pz1
El principio aufbau o de construcción
Para escribir las configuraciones electrónicas utilizaremos el principio aufbau. Aufbau es una palabra alemana que significa "construcción progresiva"; utilizaremos este método para asignar las configuraciones electrónicas a los elementos por orden de su número atómico creciente. Veamos por ejemplo como sería la configuración electrónica para Z=11-18, es decir, desde Na hasta el Ar:
Cada uno de estos elementos tiene las subcapas 1s, 2s y 2p llenas. Como la configuración 1s2 2s2 2p6 corresponde a la del neón, la denominamos "configuración interna del neón" y la representamos con el símbolo químico del neón entre corchetes, es decir, [Ne]. Los electrones que se situan en la capa electrónica del número cuántico principal más alto, los más exteriores, se denominan electrones de valencia. La configuración electrónica del Na se escribe en la forma denominada "configuración electrónica abreviada interna del gas noble" de la siguiente manera:
Na: [Ne]3s1 (consta de [Ne] para la configuración interna del gas noble y 3s1 para la configuración del electrón de valencia.
de manera análoga, podemos escribir la configuración electrónica para Mg, Al, Si, P....Mg: [Ne]3s2
Al: [Ne]3s23p1
Si: [Ne]3s23p2
P: [Ne]3s23p3
S: [Ne]3s23p4
Cl: [Ne]3s23p5
Ar: [Ne]3s23p6
Veamos un ejercicio de aplicación:
Escribir la estructura electrónica del P (Z=15) aplicando la regla de máxima multiplicidad de Hund
15P es: 1s2 2s2 2p6 3s2 3p3 (3px1 3py1 3pz1 )
Escribir la estructura electrónica del Sc (Z=21) mediante la configuración abreviada interna del gas noble
Sc: [Ar]4s23d1
Resumen
Hoy en día sabemos, además de lo anterior, que los electrones giran alrededor de los núcleos de los átomos en órbitas no solamente circulares, sino también con otras formas (elípticas, etc.). Un átomo puede tener hasta 7 órbitas o capas alrededor de su núcleo; sin embargo, no en todas ellas cabe el mismo número de electrones. Así, el número de electrones que cabe en cada cada capa u órbita “n” (n = 1, 2, 3, ...) viene dado por la expresión:
Así, en la primera capa (n = 1) habrá 2 electrones como máximo; en la segunda capa (n = 2), habrá 8 electrones como máximo; habrá 18 electrones como máximo en la tercera, etc.
A la manera en como los electrones se colocan en las capas u órbitas en la corteza de un átomo se le llama configuración electrónica del átomo.
A la capa más externa de de un átomo se le llama capa de valencia; a todos los electrones situados en dicha capa se les llama electrones de valencia. S
PRÁCTICAS





Modelo de Bohr
Cómo dibujar átomos
Isótopos
Masa atómica
Cálculo de la Masa atómica
12. NÚMERO ATÓMICO Y NÚMERO MÁSICO
Los átomos están formados por un núcleo (formado por protones y neutrones), de tamaño reducido y cargado positivamente, rodeado por una nube de electrones, que se encuentran en la corteza.
El número de protones que existen en el núcleo, es igual al número de electrones que lo rodean. Este número es un entero, que se denomina número atómico y se designa por la letra, "Z".
La suma del número de protones y neutrones en el núcleo se denomina número másico del átomo y se designa por la letra, "A".

El número de neutrones de un elemento químico se puede calcular como A-Z, es decir, como la diferencia entre el número másico y el número atómico. No todos los átomos de un elemento dado tienen la misma masa. La mayoría de los elementos tiene dos ó más isótopos, átomos que tienen el mismo número atómico, pero diferente número másico. Por lo tanto la diferencia entre dos isótopos de un elemento es el número de neutrones en el núcleo. En un elemento natural, la abundancia relativa de sus isótopos en la naturaleza recibe el nombre de abundancia isotópica natural.


La masa atómica de un elemento es la masa media ponderada de sus isótopos naturales. Por eso, la masa atómica de un elemento no es un número entero. La media ponderada quiere decir que no todos los isótopos tienen el mismo porcentaje.
Veamos un ejemplo:
El cloro tiene dos isótopos: Cl-35 en un 75,5 % y Cl-37 en un 24,5 %. Por tanto, la masa atómica media será:
M.a.= 35 uma · 75,5/100 + 37 uma · 24,5/100 = 35,49 uma. Esta masa atómica es la que aparecerá en la tabla periódica para el cloro.NOTA: Si observamos la masa atómica de cualquier elemento en la tabla periódica, veremos que dicha masa no es un número entero, sino un número decimal. Ello se debe a que para hallar la masa atómica de un elemento se calcula la media ponderada de las masas atómicas de todos los isótopos que existan de dicho elemento, es decir, teniendo en cuenta la abundancia de cada isótopo en la Naturaleza.
15.2. Cálculo de la masa molecular
La masa atómica del H vale 1 uma; la del oxígeno es de 16 u. Así pues, la masa molecular del agua
será:
H2O = 2·1 + 1·16 = 18 u
puesto que una molécula de agua contiene 2 átomos de hidrógeno y 1 de oxígeno.
Calcular la masa atómica y molecular:
16. TIPOS DE ENLACE QUÍMICO: IÓNICO, COVALENTE Y METÁLICO
Dependiendo de cómo sean los átomos que se unan, el enlace químico puede ser de 3 tipos:
16.1. Enlace iónico
Si enfrentamos un átomo al que le falten pocos electrones en su capa de valencia para adquirir la configuración de gas noble (muy electronegativo, tendencia a coger electrones), tal como el cloro, con otro cuya electronegatividad sea baja (tendencia a ceder electrones), tal como el sodio, éste cederá un electrón al cloro. Como consecuencia, el cloro se convertirá en un ión negativo (anión) mientras que el sodio se convierte en un ión positivo (catión) y ambos se unirán debido a la atracción entre cargas de distinto signo.
 El proceso fundamental consiste en la transferencia de electrones entre los átomos (uno da un electrón y el otro lo coge), formándose iones de distinto signo que se atraen:
El proceso fundamental consiste en la transferencia de electrones entre los átomos (uno da un electrón y el otro lo coge), formándose iones de distinto signo que se atraen:


Ejemplo: NaCl (cloruro sódico o sal común) → enlace iónico entre el Na (metal) y el Cl (no metal).
Na (Z = 11) : grupo 1 → 1 e- de valencia → pierde 1 electrón → se transforma en Na+
Cl (Z = 17) : grupo 17 → 7 e- de valencia → gana el electrón que pierde el Na → se transforma en Cl-
Finalmente, el catión Na+ y el anión Cl- se atraen eléctricamente al tener cargas eléctricas opuestas. A esta atracción de tipo eléctrico la llamamos enlace iónico.
Las sustancias iónicas aparecen en la naturaleza formando cristales, en los que los cationes y los aniones se colocan de manera perfectamente ordenada. Así, la estructura de la sal común resulta ser la que aparece en la figura de la izquierda. Observar que el empaquetamiento entre los átomos de sodio y de cloro es máximo.
16.2. Enlace covalente
El proceso fundamental en este tipo de enlace es la compartición de electrones. Los átomos permanecen juntos con el fin de poder compartir los electrones.
Es un enlace característico entre átomos de electronegatividad alta (no metales).
Cuando los átomos se unen mediante este tipo de enlace se forman unas nuevas entidades formadas por los átomos unidos. Son las moléculas. Las moléculas son las unidades básicas de los compuestos covalentes.
Para referirse a los compuestos se utilizan las “formulas químicas”.
Para escribir la fórmula química correspondiente a un compuesto se citan los átomos que lo forman utilizando su símbolo afectado de un subíndice que indica el número de átomos que forman la molécula.
Por ejemplo, para el caso anterior la fórmula sería HCl.
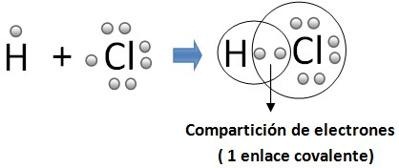

Para representar las moléculas resultantes de la unión mediante enlace covalente se utilizan mucho los diagramas de Lewis. En ellos se representan por puntos o cruces los electrones de la capa de valencia del átomo y los electrones compartidos se sitúan entre los dos átomos. De esta manera es fácil visualizar cómo ambos átomos quedan con ocho electrones (estructura de gas noble) y los electrones compartidos:
Para simplificar la escritura los electrones de enlace se representan por una raya entre ambos átomos:
H – H O = O H – O - H
Los compuestos con enlace covalente tienen las propiedades siguientes:
Propiedades de los cristales covalentes (diamante, grafito, cuarzo, piedras preciosas,…):
El enlace metálico es el que mantiene unidos los átomos de los metales. Mediante la estructura del enlace metálico de puede dar explicación a las propiedades más características de los metales tales como su facilidad para conducir la electricidad y el calor (conductividad), la capacidad para extenderse en hilos muy finos (ductilidad) , la capacidad para obtener láminas finas (maleabilidad), densidades elevadas, puntos de fusión altos...
El modelo más sencillo de enlace metálico se basa en una de las propiedades características de los metales: su baja electronegatividad (ceden electrones con facilidad). Así pues el enlace metálico podemos describirlo como una disposición muy ordenada y compacta de iones positivos del metal (red metálica) entre los cuales se distribuyen los electrones perdidos por cada átomo a modo de “nube electrónica” . Es importante observar que los electrones pueden circular libremente entre los cationes, no están ligados (sujetos) a lo núcleos y son compartidos por todos ellos. Esta nube electrónica hace de “colchón” entre las cargas positivas impidiendo que se repelan y manteniendo unidos los átomos del metal.


En los metales tampoco se forman moléculas individuales. La situación es muy parecida a la encontrada en el caso de los compuestos iónicos. La fórmula de un metal representa al átomo metálico correspondiente.
Ejemplos: Fe : hierro; Au: Oro; Cu: cobre...
Propiedades de los metales:
16.4. Fuerzas intermoleculares
Las fuerzas intermoleculares no son enlaces químicos como los estudiados hasta ahora
y sin embargo se pueden considerar como un enlace ya que son fuerzas que aparecen
entre moléculas covalentes. Estas fuerzas influyen de forma directa en los valores de
los puntos de fusión y de ebullición de estas sustancias.
Pueden ser de dos tipos:
16.4.1. Enlace por puente de hidrógeno
Se da en moléculas que contienen hidrógeno unido a un átomo pequeño de afinidad
electrónica elevada. Podrían ser ejemplos el fluoruro de hidrógeno (HF) o el agua
(H2O). En estas moléculas fuertemente polarizadas podemos ver una anormal
elevación de su punto de ebullición respecto a moléculas similares con elementos del
mismo grupo más pesados.
La explicación se puede dar pensando que parte de la nube electrónica que rodea al
elemento más electronegativo (F u O) se desplaza ligeramente hacia hidrógenos de
otras moléculas formando una especie de enlace mucho más débil que un enlace
covalente (enlace por puente de hidrógeno)
Sin embargo este "enlace" es suficiente para que, alcanzar el punto de ebullición,
suponga la necesidad de mayor energía puesto que, antes de pasar a estado gaseoso,
las moléculas deben romperse estos enlaces por puente de hidrógeno


16.4.2. Fuerzas de Van der Waals
Se trata de enlaces mucho más débiles debidos a fuerzas de atracción electrostática
entre moléculas polares. Esta polaridad puede ser permanente o instantánea como se
indica a continuación.
18. PRÁCTICAS
Construcción de compuestos 1
Construcción de compuestos 2
19. CUESTIONES







21. OTROS CONTENIDOS
El Átomo
El Enlace Químico
El átomo 2
Enlaces
Enlaces 2
Modelos atómicos
22. VÍDEOS
En éste modelo los electrones giran en órbitas circulares alrededor del núcleo; ocupando la órbita de menor energía posible, o sea la órbita más cercana posible al núcleo.
Cada órbita se corresponde con un nivel energético que recibe el nombre de número cuántico principal, se representa con la letra " n " y toma valores desde 1 hasta 7 .
| Año | Científico | Descubrimientos experimentales | Modelo atómico | ||||||
| 1808 | John Dalton |
|
| ||||||
| 1897 | J.J. Thomson |
|
| ||||||
| 1911 | E. Rutherford |
|
| ||||||
| 1913 | Niels Bohr |
|
| ||||||
11. MODELO ACTUAL DEL ÁTOMO
11.1. Teoría de De Broglie
En el mundo macroscópico resulta muy evidente la diferencia entre una partícula y una onda; dentro de los dominios de la mecánica cuántica, las cosas son diferentes. Un conjunto de partículas, como un chorro de electrones moviéndose a una determinada velocidad puede comportarse según todas las propiedades y atributos de una onda, es decir: puede reflejarse, refractarse y difractarse.
Por otro lado, un rayo de luz puede, en determinadas circunstancias, comportarse como un chorro de partículas (fotones)con una cantidad de movimiento bien definida. Asi, al incidir un rayo de luz sobre la superficie lisa de un metal se desprenden electrones de éste (efecto fotoeléctrico). La energía de los electrones arrancados al metal depende de la frecuencia de la luz incidente y de la propia naturaleza del metal.
Según la hipótesis de De Broglie, cada partícula en movimiento lleva asociada una onda, de manera que la dualidad onda-partícula puede enunciarse de la siguiente forma: una partícula de masa m que se mueva a una velocidad v puede, en condiciones experimentales adecuadas, presentarse y comportarse como una onda de longitud de onda, λ. La relación entre estas magnitudes fue establecida por el físico francés Louis de Broglie en 1924.
cuanto mayor sea la cantidad de movimiento (mv) de la partícula menor será la longitud de onda (λ), y mayor la frecuencia (ν) de la onda asociada.
11.2. Principio de incertidumbre de Heisenberg
W. Heisenberg enunció el llamado principio de incertidumbre o principio de indeterminación, según el cual es imposible medir simultáneamente, y con precisión absoluta, el valor de la posición y la cantidad de movimiento de una partícula.
Es importante insistir en que la incertidumbre no se deriva de los instrumentos de medida, sino del propio hecho de medir. Con los aparatos más precisos imaginables, la incertidumbre en la medida continúa existiendo. Así, cuanto mayor sea la precisión en la medida de una de estas magnitudes mayor será la incertidumbre en la medida de la otra variable complementaria.
11.3. Capas y subcapas atómicas
Todos los orbitales con el mismo valor del número cuántico principal, n, se encuentran en la misma capa electrónica principal o nivel principal, y todos los orbitales con los mismos valores den y l están en la misma subcapa o subnivel.
El número de subcapas en una capa principal es igual al número cuántico principal, esto es, hay una subcapa en la capa principal con n=1, dos subcapas en la capa principal con n=2, y así sucesivamente. El nombre dado a una subcapa, independientemente de la capa principal en la que se encuentre, esta determinado por el número cuántico l, de manera que como se ha indicado anteriormente: l=0 (subcapa s), l=1 (subcapa p), l=2 (subcapa d) y l=3 (subcapa f).
La imagen de los orbitales empleada habitualmente por los químicos consiste en una representación del orbital mediante superficies límite que engloban una zona del espacio donde la probabilidad de encontrar al electrón es del 99%. La extensión de estas zonas depende básicamente del número cuántico principal, n, mientras que su forma viene determinada por el número cuántico secundario, l.
Los orbitales s (l=0) tienen forma esférica. La extensión de este orbital depende del valor del número cuántico principal, asi un orbital 3s tiene la misma forma pero es mayor que un orbital 2s.
Los orbitales p (l=1) están formados por dos lóbulos idénticos que se proyectan a lo largo de un eje. La zona de unión de ambos lóbulos coincide con el núcleo atómico. Hay tres orbitales p (m=-1, m=0 y m=+1) de idéntica forma, que difieren sólo en su orientación a lo largo de los ejes x, y o z.
Los orbitales d (l=2) también están formados por lóbulos. Hay cinco tipos de orbitales d (que corresponden a m=-2, -1, 0, 1, 2) 
Los orbitales f (l=3) también tienen un aspecto multilobular. Existen siete tipos de orbitales f (que corresponden a m=-3, -2, -1, 0, +1, +2, +3).
Una vez descritos los cuatro número cuánticos, podemos utilizarlos para describir la estructura electrónica del átomo de hidrógeno:
El electrón de un átomo de hidrógeno en el estado fundamental se encuentra en el nivel de energía más bajo, es decir, n=1, y dado que la primera capa principal contiene sólo un orbital s, el número cuántico orbital es l=0. El único valor posible para el número cuántico magnético es ml=0. Cualquiera de los dos estados de spin son posibles para el electrón. Así podríamos decir que el electrón de un átomo de hidrógeno en el estado fundamental está en el orbital 1s, o que es un electrón 1s, y se representa mediante la notación:
1s1
en donde el superíndice 1 indica un electrón en el orbital 1s. Ambos estados de espín están permitidos, pero no designamos el estado de espín en esta notación.
11.4. Configuraciones electrónicas
Escribir la configuración electrónica de un átomo consiste en indicar cómo se distribuyen sus electrones entre los diferentes orbitales en las capas principales y las subcapas. Muchas de las propiedades físicas y químicas de los elementos pueden relacionarse con las configuraciones electrónicas.
Esta distribución se realiza apoyándonos en tres reglas: energía de los orbitales, principio de exclusión de Pauli y regla de Hund.
1. Los electrones ocupan los orbitales de forma que se minimice la energía del átomo. El orden exacto de llenado de los orbitales se estableció experimentalmente, principalmente mediante estudios espectroscópicos y magnéticos, y es el orden que debemos seguir al asignar las configuraciones electrónicas a los elementos. El orden de llenado de orbitales es:1s22s22p63s23p64s23d104p65s24d105p66s24f145d106p67s25f146d107p6
Empezando por la línea superior, sigue las flechas y el orden obtenido es el mismo que en la serie anterior. Debido al límite de dos electrones por orbital, la capacidad de una subcapa de electrones puede obtenerse tomando el doble del número de orbitales en la subcapa. Así, la subcapa s consiste en un orbital con una capacidad de dos electrones; la subcapa p consiste entres orbitales con una capacidad total de seis electrones; la subcapa d consiste en cinco orbitales con una capacidad total de diez electrones; la subcapa f consiste en siete orbitales con una capacidad total de catorce electrones.
En un determinado átomo los electrones van ocupando, y llenando, los orbitales de menor energía; cuando se da esta circunstancia el átomo se encuentra en su estado fundamental. Si el átomo recibe energía, alguno de sus electrones más externos pueden saltar a orbitales de mayor energía, pasando el átomo a un estado excitado
11.5. Principio de exclusión de Pauli.
En un átomo no puede haber dos electrones con los cuatro número cuánticos iguales.
Los tres primeros número cuánticos, n, l y ml determinan un orbital específico. Dos electrones, en un átomo, pueden tener estos tres números cuánticos iguales, pero si es así, deben tener valores diferentes del número cuántico de espín. Podríamos expresar esto diciendo lo siguiente: en un orbital solamente puede estar ocupado por dos electrones y estos electrones deben tener espines opuestos.
11.6. Regla de Hund.
Al llenar orbitales de igual energía (los tres orbitales p, los cinco orbitales d, o los siete orbitales f) los electrones se distribuyen, siempre que sea posible, con sus espines paralelos, es decir, desapareados.
Ejemplo:
La estructura electrónica del 7N es: 1s2 2s2 2px1 2py1 2pz1
El principio aufbau o de construcción
Para escribir las configuraciones electrónicas utilizaremos el principio aufbau. Aufbau es una palabra alemana que significa "construcción progresiva"; utilizaremos este método para asignar las configuraciones electrónicas a los elementos por orden de su número atómico creciente. Veamos por ejemplo como sería la configuración electrónica para Z=11-18, es decir, desde Na hasta el Ar:
Cada uno de estos elementos tiene las subcapas 1s, 2s y 2p llenas. Como la configuración 1s2 2s2 2p6 corresponde a la del neón, la denominamos "configuración interna del neón" y la representamos con el símbolo químico del neón entre corchetes, es decir, [Ne]. Los electrones que se situan en la capa electrónica del número cuántico principal más alto, los más exteriores, se denominan electrones de valencia. La configuración electrónica del Na se escribe en la forma denominada "configuración electrónica abreviada interna del gas noble" de la siguiente manera:
Na: [Ne]3s1 (consta de [Ne] para la configuración interna del gas noble y 3s1 para la configuración del electrón de valencia.
de manera análoga, podemos escribir la configuración electrónica para Mg, Al, Si, P....Mg: [Ne]3s2
Al: [Ne]3s23p1
Si: [Ne]3s23p2
P: [Ne]3s23p3
S: [Ne]3s23p4
Cl: [Ne]3s23p5
Ar: [Ne]3s23p6
Veamos un ejercicio de aplicación:
Escribir la estructura electrónica del P (Z=15) aplicando la regla de máxima multiplicidad de Hund
15P es: 1s2 2s2 2p6 3s2 3p3 (3px1 3py1 3pz1 )
Escribir la estructura electrónica del Sc (Z=21) mediante la configuración abreviada interna del gas noble
Sc: [Ar]4s23d1
Resumen
Hoy en día sabemos, además de lo anterior, que los electrones giran alrededor de los núcleos de los átomos en órbitas no solamente circulares, sino también con otras formas (elípticas, etc.). Un átomo puede tener hasta 7 órbitas o capas alrededor de su núcleo; sin embargo, no en todas ellas cabe el mismo número de electrones. Así, el número de electrones que cabe en cada cada capa u órbita “n” (n = 1, 2, 3, ...) viene dado por la expresión:
nº de electrones en la capa “n” = 2n2
Así, en la primera capa (n = 1) habrá 2 electrones como máximo; en la segunda capa (n = 2), habrá 8 electrones como máximo; habrá 18 electrones como máximo en la tercera, etc.
A la manera en como los electrones se colocan en las capas u órbitas en la corteza de un átomo se le llama configuración electrónica del átomo.
A la capa más externa de de un átomo se le llama capa de valencia; a todos los electrones situados en dicha capa se les llama electrones de valencia. S
PRÁCTICAS





|
Ejercicios de configuración electrónica Aprende el orden en el que se rellenan los orbitales |
| Configuración electrónica Estructura electrónica de los elementos químicos. | Constructor de átomos Construye átomos, iones e isótopos de los elementos. | ||
| Cálculo de la cantidad de sustancia Ejercicios para calcular la cantidad de sustancia | Ejercicios de configuración electrónica Aprende el orden en el que se rellenan los orbitales. | ||
| Modelo atómico de Bohr Modelo de Bohr para el átomo de Hidrógeno. Selecciona la energía del fotón. | Moléculas 3D Mueve las moléculas con el ratón. | ||
| Orbitales atómicos Un orbital atómico es una zona del espacio donde existe una alta probabilidad (superior al 90%) de encontrar al electrón. | Partículas de los átomos e iones Aprende a interpretar los símbolos de los elementos. |
| Energía de los orbitales Orden de llenado de los orbitales atómicos. |
Modelo de Bohr
Cómo dibujar átomos
Isótopos
Masa atómica
Cálculo de la Masa atómica
12. NÚMERO ATÓMICO Y NÚMERO MÁSICO
Los átomos están formados por un núcleo (formado por protones y neutrones), de tamaño reducido y cargado positivamente, rodeado por una nube de electrones, que se encuentran en la corteza.
El número de protones que existen en el núcleo, es igual al número de electrones que lo rodean. Este número es un entero, que se denomina número atómico y se designa por la letra, "Z".
La suma del número de protones y neutrones en el núcleo se denomina número másico del átomo y se designa por la letra, "A".
donde X es el símbolo del correspondiente elemento. A los números Z y A se les llama números atómico y másico, respectivamente:
- Número atómico (Z): es el número de protones que hay en el núcleo de un átomo.
- Número másico (A): es el número de nucleones (o suma de protones y de neutrones) que hay en el núcleo de un átomo.
La nube de carga electrónica constituye casi todo el volumen del átomo, pero, sólo representa una pequeña parte de su masa. Los electrones, particularmente la masa externa determinan la mayoría de las propiedades mecánicas, eléctricas, químicas, etc., de los átomos, y así, un conocimiento básico de estructura atómica es importante en el estudio básico de los materiales de ingeniería.
Veamos una serie de ejemplos
Para el carbono Z=6. Es decir, todos los átomos de carbono tienen 6 protones y 6 electrones.
El carbono tiene dos isótopos: uno con A=12, con 6 neutrones y otro con número másico 13 (7 neutrones), que se representan como:


El carbono con número másico 12 es el más común (~99% de todo el carbono). Al otro isótopo se le denomina carbono-13.



hidrógeno deuterio tritio


13. CONCEPTO Y TIPOS DE ISÓTOPOS
Al contrario de lo que pensaba Dalton, no todos los átomos del mismo elemento son iguales entre sí. De hecho, de cada elemento químico suelen existir en la naturaleza varios átomos diferentes.
Así, decimos que dos o más átomos del mismo elemento químico son isótopos entre sí cuando tienen el mismo número atómico y distinto número másico, esto es, el mismo nº de protones y electrones pero diferente nº de neutrones.
A modo de ejemplo, mostramos en la figura siguiente los tres isótopos del hidrógeno que existen en la Naturaleza: el protio, el deuterio y el tritio.
13.1. CONCEPTO Y TIPOS DE IONES
Lo más habitual es que los átomos sean neutros; sin embargo, en algunas ocasiones pueden adquirir carga eléctrica. A un átomo con carga eléctrica se le llama ión. Existen 2 tipos de iones:
 Se trata de un átomo de sodio ; contiene 11 protones,
12 neutrones y 11 electrones. El catión Na+ tendrá una carga eléctrica positiva y por tanto un electrón menos (10 electrones)
Se trata de un átomo de sodio ; contiene 11 protones,
12 neutrones y 11 electrones. El catión Na+ tendrá una carga eléctrica positiva y por tanto un electrón menos (10 electrones)
se trata de un átomo de cloro ; contiene 17 protones, 18 neutrones y 17 electrones. El anión CL- tendrá una carga eléctrica negativa (anión) y tendrá 18 electrones
14. SISTEMA PERIÓDICO DE LOS ELEMENTOS QUÍMICOS
14.1. Evolución histórica
A mediados del siglo XVII se conocían 13 elementos químicos. En el año 1800 se conocían solamente 26, y en el año 1830 ya se conocían 55. Es por ello por lo que los científicos de la época comenzaron a preocuparse por buscar una manera lógica de ordenar todos los elementos que se iban descubriendo. Tras algunos intentos fallidos, los primeros científicos que con acierto comenzaron a ordenar los elementos químicos conocidos fueron el químico alemán Lothar Meyer y el ruso Dimitri Mendeleiev (en la figura). Ambos, simultánea pero independientemente, ordenaron en 1869 los 63 elementos químicos que se conocían de menor a mayor masa atómica. De esta manera, observaron que los elementos químicos con propiedades parecidas aparecían en la misma columna, es decir, las propiedades químicas de los elementos se repetían de manera periódica. Esta manera de clasificar los elementos tuvo mucho éxito, pues Mendeleiev dejó algunos huecos en su tabla en los que deberían situarse elementos químicos aún no descubiertos, lo cual se comprobó más tarde.
Sin embargo, la tabla periódica de Mendeleiev también tenía algunos errores, pues algunos elementos estaban colocados donde no debían. Por ello, el cientí- fico inglés Henry Moseley propuso en el año 1913 ordenar los elementos químicos de menor a mayor número atómico. De esta manera, obtuvo una tabla periódica muy parecida a la de Mendeleiev, y que además no contenía los errores que había en ella, en la que las propiedades de los elementos se repetían cada vez que se baja- ba de fila ( ley perió dica). De hecho, la tabla periódica, tal y como la conocemos en la actualidad, se ordena de la misma manera que propuso Moseley.
14.2. Estructura de la tabla periódica
La tabla periódica (o sistema periódico) actual contiene los 114 elementos químicos conocidos y ordenados en orden creciente (de menor a mayor) de número atómico. De estos 114 elementos, 89 son naturales (existen en la Naturaleza) y el resto son artificiales (se han obtenido en los laboratorios).
El sistema periódico se estructura en columnas y en filas; esta manera de ordenar los elementos es la que le confiere una gran importancia:
15. UNIONES ENTRE ÁTOMOS: ENLACE QUÍMICO
En la naturaleza son muy pocos los átomos que se encuentran libres o aislados; de hecho, la mayoría de los átomos aparecen unidos a otros átomos, formando moléculas o cristales. Ello se debe a que cuando los átomos están unidos tienen menor energía que cuando se encuentran libres, por lo que alcanzan mayor estabilidad.
Llamamos enlace químico a la unión existente entre dos átomos
Los átomos más estables son los gases nobles, que tienen (a excepción del helio) 8 electrones de valencia. Así, cuando los átomos se unen siempre intentan alcanzar la estructura externa de gas noble, es decir, ganan, pierden o comparten electrones de valencia de manera que en su última capa haya 8 electrones (regla del octeto). Los electrones de valencia son, por tanto, los que permiten el enlace químico entre los átomos.
Hemos dicho que los átomos pueden formar moléculas o cristales cuando se unen entre ellos:


15. MASAS ATÓMICAS Y MOLECULARES. CONCEPTO DE UNIDAD DE MASA ATÓMICA
Hemos visto antes que las masas de las partículas subatómicas fundamentales son muy pequeñas si las expresamos en gramos o en kilogramos. Es por ello por lo que cuando tenemos que expresar la masa de un átomo o de una molécula debemos utilizar una unidad de masa más adecuada, es decir, más pequeña. A esta unidad se le llama unidad de masa atómica (abreviadamente, uma ó u), cuyo valor es el siguiente:
Así, decimos que la masa atómica es la masa de un átomo expresada en unidades de masa atómica (uma ó u); la masa molecular será la masa de una molécula (o del cristal más sencillo de una cierta sustancia) expresada en unidades de masa atómica (uma ó u). Para hallar la masa molecular de una sustancia, sumamos las masas atómicas de los átomos que la forman.
15.1. Cálculo de la Masa Atómica
Como hemos visto, no todos los átomos de un elemento son exactamente iguales. La mayoría de los elementos presentan diferentes isótopos y esto hay que considerarlo para calcular la masa atómica.
Veamos una serie de ejemplos
Para el carbono Z=6. Es decir, todos los átomos de carbono tienen 6 protones y 6 electrones.
El carbono tiene dos isótopos: uno con A=12, con 6 neutrones y otro con número másico 13 (7 neutrones), que se representan como:
El carbono con número másico 12 es el más común (~99% de todo el carbono). Al otro isótopo se le denomina carbono-13.
El hidrógeno presenta tres isótopos, y en este caso particular cada uno tiene un nombre diferente
La forma más común es el hidrógeno, que es el único átomo que no tiene neutrones en su núcleo.
Otro ejemplo son los dos isótopos más comunes del uranio:
los cuales se denominan uranio-235 y uranio-238.
En general las propiedades químicas de un elemento están determinadas fundamentalmente por los protones y electrones de sus átomos y en condiciones normales los neutrones no participan en los cambios químicos. Por ello los isótopos de un elemento tendrán un comportamiento químico similar, formarán el mismo tipo de compuestos y reaccionarán de manera semejante.
12.1. Masa atómica
La masa atómica relativa de un elemento, es la masa en gramos de 6.02 ·1023 átomos (número de Avogadro, NA) de ese elemento, la masa relativa de los elementos de la tabla periódica desde el 1 hasta el 105 esta situada en la parte inferior de los símbolos de dichos elementos. El átomo de carbono, con 6 protones y 6 neutrones, es el átomo de carbono 12 y es la masa de referencia para las masas atómicas. Una unidad de masa atómica (u.m.a), se define exactamente como 1/12 de la masa de un átomo de carbono que tiene una masa 12 u.m.a. una masa atómica relativa molar de carbono 12 tiene una masa de 12 g en esta escala. Un mol gramo (abreviado, mol) de un elemento se define como el numero en gramos de ese elemento igual al número que expresa su masa relativa molar. Así, por ejemplo, un mol gramo de aluminio tiene una masa de 26.98 g y contiene 6.023 ·1023 átomos.
Veamos unos ejercicios de aplicación:
La plata natural está constituida por una mezcla de dos isótopos de números másicos 107 y 109. Sabiendo que abundancia isotópica es la siguiente: 107Ag =56% y 109Ag =44%. Deducir el peso atómico de la plata natural.
Determinar la masa atómica del galio, sabiendo que existen dos isótopos 69Ga y 71Ga, cuya abundancia relativa es, respectivamente, 60,2% y 39,8%. Indica la composición de los núcleos de ambos isótopos sabiendo que el número atómico del galio es 31.
Masa atómica = 69 · 0,602 + 71 · 0,398 = 69,7 u
Núcleo del 6931Ga: 31 protones y 38 neutrones (69 - 31)
Núcleo del 7131Ga: 31 protones y 40 neutrones (71 - 31).
13. CONCEPTO Y TIPOS DE ISÓTOPOS
Al contrario de lo que pensaba Dalton, no todos los átomos del mismo elemento son iguales entre sí. De hecho, de cada elemento químico suelen existir en la naturaleza varios átomos diferentes.
Así, decimos que dos o más átomos del mismo elemento químico son isótopos entre sí cuando tienen el mismo número atómico y distinto número másico, esto es, el mismo nº de protones y electrones pero diferente nº de neutrones.
A modo de ejemplo, mostramos en la figura siguiente los tres isótopos del hidrógeno que existen en la Naturaleza: el protio, el deuterio y el tritio.
13.1. CONCEPTO Y TIPOS DE IONES
Lo más habitual es que los átomos sean neutros; sin embargo, en algunas ocasiones pueden adquirir carga eléctrica. A un átomo con carga eléctrica se le llama ión. Existen 2 tipos de iones:
- Catión: es un átomo que tiene carga eléctrica positiva, lo cual significa que ha perdido uno o varios electrones de su capa más externa.
- Anión: es un átomo que tiene carga eléctrica negativa, lo cual significa que ha ganado uno o varios electrones procedentes de otro átomo y los ha incorporado a su capa más externa.
se trata de un átomo de cloro ; contiene 17 protones, 18 neutrones y 17 electrones. El anión CL- tendrá una carga eléctrica negativa (anión) y tendrá 18 electrones
14. SISTEMA PERIÓDICO DE LOS ELEMENTOS QUÍMICOS
14.1. Evolución histórica
A mediados del siglo XVII se conocían 13 elementos químicos. En el año 1800 se conocían solamente 26, y en el año 1830 ya se conocían 55. Es por ello por lo que los científicos de la época comenzaron a preocuparse por buscar una manera lógica de ordenar todos los elementos que se iban descubriendo. Tras algunos intentos fallidos, los primeros científicos que con acierto comenzaron a ordenar los elementos químicos conocidos fueron el químico alemán Lothar Meyer y el ruso Dimitri Mendeleiev (en la figura). Ambos, simultánea pero independientemente, ordenaron en 1869 los 63 elementos químicos que se conocían de menor a mayor masa atómica. De esta manera, observaron que los elementos químicos con propiedades parecidas aparecían en la misma columna, es decir, las propiedades químicas de los elementos se repetían de manera periódica. Esta manera de clasificar los elementos tuvo mucho éxito, pues Mendeleiev dejó algunos huecos en su tabla en los que deberían situarse elementos químicos aún no descubiertos, lo cual se comprobó más tarde.
Sin embargo, la tabla periódica de Mendeleiev también tenía algunos errores, pues algunos elementos estaban colocados donde no debían. Por ello, el cientí- fico inglés Henry Moseley propuso en el año 1913 ordenar los elementos químicos de menor a mayor número atómico. De esta manera, obtuvo una tabla periódica muy parecida a la de Mendeleiev, y que además no contenía los errores que había en ella, en la que las propiedades de los elementos se repetían cada vez que se baja- ba de fila ( ley perió dica). De hecho, la tabla periódica, tal y como la conocemos en la actualidad, se ordena de la misma manera que propuso Moseley.
14.2. Estructura de la tabla periódica
La tabla periódica (o sistema periódico) actual contiene los 114 elementos químicos conocidos y ordenados en orden creciente (de menor a mayor) de número atómico. De estos 114 elementos, 89 son naturales (existen en la Naturaleza) y el resto son artificiales (se han obtenido en los laboratorios).
El sistema periódico se estructura en columnas y en filas; esta manera de ordenar los elementos es la que le confiere una gran importancia:
- Contiene 18 columnas, grupos o familias, en los cuales se sitúan los elementos que tienen propiedades químicas parecidas, esto es, forman compuestos químicos parecidos y participan en procesos químicos parecidos. Además, todos los elementos químicos situados en el mismo grupo o columna tienen el mismo número de electrones de valencia, es decir, tienen la misma configuración electrónica externa.
- Contiene también 7 filas o períodos, a lo largo de las cuales las propiedades químicas de los elementos varían de forma regular (aumentando o disminuyendo). Es por ello por lo que se les llama propiedades periódicas. Así, por ejemplo, cuando avanzamos hacia la izquierda en un período aumenta el carácter metálico de los elementos. Además, todos los elementos químicos situados en la misma fila o período tienen el mismo número de capas de electrones en su corteza.
- Los metales se encuentran en las zonas izquierda y central de la tabla periódica; los no metales se sitúan en la parte derecha. Las propiedades más importantes de ambos tipos de elementos son las siguientes:
- Metales: se caracterizan porque poseen 1, 2 ó 3 electrones de valencia. La mayoría de los elementos químicos conocidos son metales. Sus propiedades más importantes son:
- Tienen brillo metálico.
- Suelen ser duros.
- Conducen la electricidad y el calor.
- Tienen densidades altas.
- Suelen tener altos puntos de fusión y de ebullición.
- No metales: se caracterizan porque poseen 4, 5, 6 ó 7 electrones de valencia. Algunas de sus propiedades más importantes son:
- Suelen ser aislantes caloríficos y eléctricos.
- Suelen ser blandos o frágiles.
- Tienen densidades bajas.
- Suelen tener bajos puntos de fusión y de ebullición.
- Los distintos grupos tienen nombres tradicionales que siguen empleándose; estos nombres son los siguientes:
15. UNIONES ENTRE ÁTOMOS: ENLACE QUÍMICO
En la naturaleza son muy pocos los átomos que se encuentran libres o aislados; de hecho, la mayoría de los átomos aparecen unidos a otros átomos, formando moléculas o cristales. Ello se debe a que cuando los átomos están unidos tienen menor energía que cuando se encuentran libres, por lo que alcanzan mayor estabilidad.
Llamamos enlace químico a la unión existente entre dos átomos
Los átomos más estables son los gases nobles, que tienen (a excepción del helio) 8 electrones de valencia. Así, cuando los átomos se unen siempre intentan alcanzar la estructura externa de gas noble, es decir, ganan, pierden o comparten electrones de valencia de manera que en su última capa haya 8 electrones (regla del octeto). Los electrones de valencia son, por tanto, los que permiten el enlace químico entre los átomos.
Hemos dicho que los átomos pueden formar moléculas o cristales cuando se unen entre ellos:
- Una molécula es la unión de un número relativamente pequeño de átomos.
- Un cristal es la unión de un elevado número de átomos, estando éstos perfectamente ordenados en el espacio.
- Las letras nos indican los símbolos de los elementos químicos que forman la molécula o el cristal.
- Los números nos indican el número de átomos de cada elemento químico que forman la sustancia. Se escriben abajo y a la derecha de cada símbolo. En caso de tratarse de una molécula, dichos números nos indican el nº real de átomos que contiene; en caso de tratarse de un cristal, nos indica la relación más sencilla entre el nº de átomos que existe en la sustancia.
- El agua es una molécula de fórmula H2O. Esta fórmula nos indica que una molécula de agua contiene 2 átomos de hidrógeno y un átomo de oxígeno.
- La sal es una sustancia cristalina cuya fórmula es NaCl. Esta fórmula nos indica que en un trozo de sal hay un átomo de sodio por cada átomo de cloro, es decir, hay el mismo nº de átomos de ambos elementos.

15. MASAS ATÓMICAS Y MOLECULARES. CONCEPTO DE UNIDAD DE MASA ATÓMICA
Hemos visto antes que las masas de las partículas subatómicas fundamentales son muy pequeñas si las expresamos en gramos o en kilogramos. Es por ello por lo que cuando tenemos que expresar la masa de un átomo o de una molécula debemos utilizar una unidad de masa más adecuada, es decir, más pequeña. A esta unidad se le llama unidad de masa atómica (abreviadamente, uma ó u), cuyo valor es el siguiente:
1 uma = 1´66·10-27 kg
Así, decimos que la masa atómica es la masa de un átomo expresada en unidades de masa atómica (uma ó u); la masa molecular será la masa de una molécula (o del cristal más sencillo de una cierta sustancia) expresada en unidades de masa atómica (uma ó u). Para hallar la masa molecular de una sustancia, sumamos las masas atómicas de los átomos que la forman.
15.1. Cálculo de la Masa Atómica
Como hemos visto, no todos los átomos de un elemento son exactamente iguales. La mayoría de los elementos presentan diferentes isótopos y esto hay que considerarlo para calcular la masa atómica.
La masa atómica de un elemento es la masa media ponderada de sus isótopos naturales. Por eso, la masa atómica de un elemento no es un número entero. La media ponderada quiere decir que no todos los isótopos tienen el mismo porcentaje.
Veamos un ejemplo:
El cloro tiene dos isótopos: Cl-35 en un 75,5 % y Cl-37 en un 24,5 %. Por tanto, la masa atómica media será:
M.a.= 35 uma · 75,5/100 + 37 uma · 24,5/100 = 35,49 uma. Esta masa atómica es la que aparecerá en la tabla periódica para el cloro.NOTA: Si observamos la masa atómica de cualquier elemento en la tabla periódica, veremos que dicha masa no es un número entero, sino un número decimal. Ello se debe a que para hallar la masa atómica de un elemento se calcula la media ponderada de las masas atómicas de todos los isótopos que existan de dicho elemento, es decir, teniendo en cuenta la abundancia de cada isótopo en la Naturaleza.
15.2. Cálculo de la masa molecular
El cálculo del peso molecular (en el caso de las moléculas) o peso-fórmula (en el caso de las sales) es fácil.
- Tenemos la fórmula de un compuesto como el cloruro de sódio,
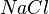 . Tomamos los pesos atómicos de los elementos que lo componen y multiplicamos cada peso atómico por el subíndice que corresponde al elemento según la fórmula.
. Tomamos los pesos atómicos de los elementos que lo componen y multiplicamos cada peso atómico por el subíndice que corresponde al elemento según la fórmula.
Veamos, como ejemplo, el caso de la sal de mesa, cloruro de sodio 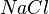 que corresponde a un compuesto iónico, una sal.
que corresponde a un compuesto iónico, una sal.
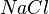 que corresponde a un compuesto iónico, una sal.
que corresponde a un compuesto iónico, una sal.
Los pesos atómicos de los elementos son: Na= 22,9898 y Cl= 35.5. Según la fórmula, tenemos un subíndice igual a 1 en ambos casos.
Entonces hagamos una tabulación:
Na
| 22,9898 x 1 = 22,9898 |
Cl
| 35,5 x 1 = 35,5 |
| Suma = 58,4898 g/mol | |
Pero hemos citado una sustancia que contiene enlaces iónicos, de modo que en ella no existen moléculas "verdaderas", sino asociaciones tridimensionales de iones, que se reúnen según ciertas reglas eléctricas y geométricas. La representación 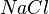 solamente nos indica que hay un ión (Na)+ por cada ión (Cl)-, y por eso lo que se ha hallado es el peso-fórmula del material.
solamente nos indica que hay un ión (Na)+ por cada ión (Cl)-, y por eso lo que se ha hallado es el peso-fórmula del material.
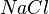 solamente nos indica que hay un ión (Na)+ por cada ión (Cl)-, y por eso lo que se ha hallado es el peso-fórmula del material.
solamente nos indica que hay un ión (Na)+ por cada ión (Cl)-, y por eso lo que se ha hallado es el peso-fórmula del material.- Intentemos con el azúcar, una molécula orgánica compuesta por 12 carbonos, 22 hidrógenos y 11 oxígenos:
 , y hacemos la siguiente tabulación:
, y hacemos la siguiente tabulación:
C
| 12,0 x 12 = 144,0 |
H
| 1,0 x 22 = 22.0 |
O
| 16,0 x 11 = 176.0 |
| Suma = 342,0 g/mol | |
Aunque hemos utilizado el término "peso molecular" debido a su uso extendido, la expresión científicamente correcta es "masa molecular". El peso es una fuerza, es decir una cantidad vectorial que posee módulo, dirección y sentido y depende del campo gravitacional en el que se encuentre inmerso. La masa, en cambio es un escalar y es independiente del campo gravitacional.
Si la masa se expresa sin unidades se denomina "masa molecular relativa", mientras que si la unidad es "g/mol" recibe el nombre de "masa molar".
Calcular la masa atómica y molecular:
16. TIPOS DE ENLACE QUÍMICO: IÓNICO, COVALENTE Y METÁLICO
Dependiendo de cómo sean los átomos que se unan, el enlace químico puede ser de 3 tipos:
16.1. Enlace iónico
Si enfrentamos un átomo al que le falten pocos electrones en su capa de valencia para adquirir la configuración de gas noble (muy electronegativo, tendencia a coger electrones), tal como el cloro, con otro cuya electronegatividad sea baja (tendencia a ceder electrones), tal como el sodio, éste cederá un electrón al cloro. Como consecuencia, el cloro se convertirá en un ión negativo (anión) mientras que el sodio se convierte en un ión positivo (catión) y ambos se unirán debido a la atracción entre cargas de distinto signo.
 El proceso fundamental consiste en la transferencia de electrones entre los átomos (uno da un electrón y el otro lo coge), formándose iones de distinto signo que se atraen:
El proceso fundamental consiste en la transferencia de electrones entre los átomos (uno da un electrón y el otro lo coge), formándose iones de distinto signo que se atraen:
Realmente este proceso se realiza
simultáneamente en millones de átomos, con el resultado de que se formarán
millones de iones positivos y negativos que se atraen mutuamente formando una
estructura integrada por un número muy elevado de iones dispuestos en forma muy
ordenada. Es lo que se llama red iónica o cristal.
Este enlace tendrá lugar
entre átomos de electronegatividad muy distinta: entre metales y no metales.
En los compuestos iónicos no se puede
hablar de moléculas individuales, sino de grandes agregados.
Por tanto, en los compuestos
iónicos la fórmula representa la proporción en la que los iones se encuentran
en el compuesto.
Ejemplos:
NaCl.
La relación de iones de Na+ e iones Cl – es 1:1 (hay el mismo número de
ambos)
CaCl2. Hay doble número de iones Cl – que de iones
Ca2+
Los compuestos iónicos tienen
las siguientes propiedades:
- Son sólidos cristalinos: estructura muy ordenada
- Poseen puntos de fusión y ebullición elevados, síntoma de que el enlace es fuerte.
- Suelen ser solubles en agua.
- Fundidos o en disolución acuosa son buenos conductores de la corriente eléctrica, debido a la existencia de cargas libres (iones).
Ejemplo: NaCl (cloruro sódico o sal común) → enlace iónico entre el Na (metal) y el Cl (no metal).
Na (Z = 11) : grupo 1 → 1 e- de valencia → pierde 1 electrón → se transforma en Na+
Cl (Z = 17) : grupo 17 → 7 e- de valencia → gana el electrón que pierde el Na → se transforma en Cl-
Finalmente, el catión Na+ y el anión Cl- se atraen eléctricamente al tener cargas eléctricas opuestas. A esta atracción de tipo eléctrico la llamamos enlace iónico.
Las sustancias iónicas aparecen en la naturaleza formando cristales, en los que los cationes y los aniones se colocan de manera perfectamente ordenada. Así, la estructura de la sal común resulta ser la que aparece en la figura de la izquierda. Observar que el empaquetamiento entre los átomos de sodio y de cloro es máximo.
16.2. Enlace covalente
Si
los átomos que se enfrentan son ambos electronegativos (no metales), ninguno de
los dos cederá electrones. Una manera de adquirir la configuración de gas noble
en su última capa es permanecer juntos con el fin de compartir electrones.
Es un enlace característico entre átomos de electronegatividad alta (no metales).
Cuando los átomos se unen mediante este tipo de enlace se forman unas nuevas entidades formadas por los átomos unidos. Son las moléculas. Las moléculas son las unidades básicas de los compuestos covalentes.
Para referirse a los compuestos se utilizan las “formulas químicas”.
Para escribir la fórmula química correspondiente a un compuesto se citan los átomos que lo forman utilizando su símbolo afectado de un subíndice que indica el número de átomos que forman la molécula.
Por ejemplo, para el caso anterior la fórmula sería HCl.

Para representar las moléculas resultantes de la unión mediante enlace covalente se utilizan mucho los diagramas de Lewis. En ellos se representan por puntos o cruces los electrones de la capa de valencia del átomo y los electrones compartidos se sitúan entre los dos átomos. De esta manera es fácil visualizar cómo ambos átomos quedan con ocho electrones (estructura de gas noble) y los electrones compartidos:
Para simplificar la escritura los electrones de enlace se representan por una raya entre ambos átomos:
H – H O = O H – O - H
Los compuestos con enlace covalente tienen las propiedades siguientes:
- Son gases o líquidos (entre las moléculas formadas casi no hay fuerzas que las mantengan unidas)
- Tienen puntos de fusión y ebullición bajos.
- Suelen ser poco solubles en agua.
- Disueltos en agua conducen mal la corriente eléctrica. (no existen cargas libres)
- Suelen ser malos conductores del calor
Propiedades de los cristales covalentes (diamante, grafito, cuarzo, piedras preciosas,…):
- Suelen ser muy duros a temperatura ambiente.
- Tienen altos puntos de fusión y de ebullición. • Suelen ser poco solubles en agua.
- Suelen ser malos conductores del calor y de la electricidad.
El enlace metálico es el que mantiene unidos los átomos de los metales. Mediante la estructura del enlace metálico de puede dar explicación a las propiedades más características de los metales tales como su facilidad para conducir la electricidad y el calor (conductividad), la capacidad para extenderse en hilos muy finos (ductilidad) , la capacidad para obtener láminas finas (maleabilidad), densidades elevadas, puntos de fusión altos...
El modelo más sencillo de enlace metálico se basa en una de las propiedades características de los metales: su baja electronegatividad (ceden electrones con facilidad). Así pues el enlace metálico podemos describirlo como una disposición muy ordenada y compacta de iones positivos del metal (red metálica) entre los cuales se distribuyen los electrones perdidos por cada átomo a modo de “nube electrónica” . Es importante observar que los electrones pueden circular libremente entre los cationes, no están ligados (sujetos) a lo núcleos y son compartidos por todos ellos. Esta nube electrónica hace de “colchón” entre las cargas positivas impidiendo que se repelan y manteniendo unidos los átomos del metal.

En los metales tampoco se forman moléculas individuales. La situación es muy parecida a la encontrada en el caso de los compuestos iónicos. La fórmula de un metal representa al átomo metálico correspondiente.
Ejemplos: Fe : hierro; Au: Oro; Cu: cobre...
Propiedades de los metales:
- Son sólidos a temperatura ambiente (a excepción del mercurio) de densidad elevada. Observa que la red metálica postula una estructura muy ordenada (típica de los sólidos) y compacta (con los iones muy bien empaquetados, muy juntos, densidad alta)
- Temperaturas de fusión y ebullición altas: síntoma de que el enlace entre los átomos es fuerte.
- Buenos conductores del calor y la electricidad: debido a la existencia de electrones libres que pueden moverse.
- Ductilidad y maleabilidad: debido a la posibilidad de que las capas de iones se puedan deslizar unas sobre otras sin que se rompa la red metálica
16.4. Fuerzas intermoleculares
Las fuerzas intermoleculares no son enlaces químicos como los estudiados hasta ahora
y sin embargo se pueden considerar como un enlace ya que son fuerzas que aparecen
entre moléculas covalentes. Estas fuerzas influyen de forma directa en los valores de
los puntos de fusión y de ebullición de estas sustancias.
Pueden ser de dos tipos:
16.4.1. Enlace por puente de hidrógeno
Se da en moléculas que contienen hidrógeno unido a un átomo pequeño de afinidad
electrónica elevada. Podrían ser ejemplos el fluoruro de hidrógeno (HF) o el agua
(H2O). En estas moléculas fuertemente polarizadas podemos ver una anormal
elevación de su punto de ebullición respecto a moléculas similares con elementos del
mismo grupo más pesados.
La explicación se puede dar pensando que parte de la nube electrónica que rodea al
elemento más electronegativo (F u O) se desplaza ligeramente hacia hidrógenos de
otras moléculas formando una especie de enlace mucho más débil que un enlace
covalente (enlace por puente de hidrógeno)
Sin embargo este "enlace" es suficiente para que, alcanzar el punto de ebullición,
suponga la necesidad de mayor energía puesto que, antes de pasar a estado gaseoso,
las moléculas deben romperse estos enlaces por puente de hidrógeno
16.4.2. Fuerzas de Van der Waals
Se trata de enlaces mucho más débiles debidos a fuerzas de atracción electrostática
entre moléculas polares. Esta polaridad puede ser permanente o instantánea como se
indica a continuación.
17. FÓRMULAS E INFORMACIÓN Una fórmula es la representación abreviada de una molécula, y en una primera aproximación nos dice qué átomos la integran y en qué proporción se combinan. Ejemplos: Además de esto, a la vista de la fórmula de un compuesto, podemos saber:
|
ANIMACIONES

Características de los enlaces
Completa la tabla arrastrando las etiquetas para organizar la información sobre las características principales de los enlaces. 
Enlace iónico
Los compuestos iónicos son redes de átomos cargados eléctricamente. 
Fuerzas entre los átomos
Fuerzas atractivas y repulsivas entre los átomos 
Naturaleza del enlace químico
La diferencia de electronegatividad determina la naturaleza del enlace. 
Polaridad de los enlaces
Ordena los enlaces de menor a mayor polaridad. 
Completa el esquema colocando las etiquetas.
| Características de los enlaces Completa la tabla arrastrando las etiquetas para organizar la información sobre las características principales de los enlaces. | Enlace iónico Los compuestos iónicos son redes de átomos cargados eléctricamente. | ||
| Fuerzas entre los átomos Fuerzas atractivas y repulsivas entre los átomos | Naturaleza del enlace químico La diferencia de electronegatividad determina la naturaleza del enlace. | ||
| Polaridad de los enlaces Ordena los enlaces de menor a mayor polaridad. |
Completa el esquema colocando las etiquetas.
|
18. PRÁCTICAS
Construcción de compuestos 1
Construcción de compuestos 2
19. CUESTIONES







21. OTROS CONTENIDOS
El Átomo
El Enlace Químico
El átomo 2
Enlaces
Enlaces 2
Modelos atómicos
22. VÍDEOS












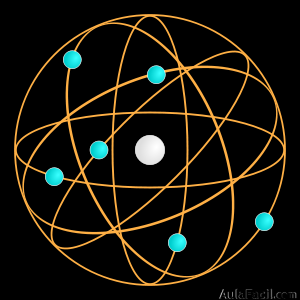






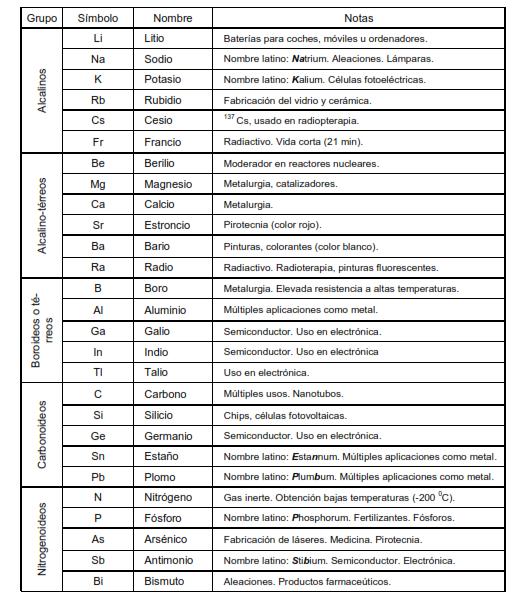





No hay comentarios:
Publicar un comentario